
科目: 来源:辽宁省葫芦岛市高三第一次模拟考试理综化学试卷 题型:选择题
在一定条件下,苯与氯气在氯化铁催化下连续反应,生成以氯苯、氯化氢为主要产物,邻二氯苯、对二氯苯为次要产物的粗氯代苯混合物。有关物质的沸点如下:
氯苯 | 邻二氯苯 | 对二氯苯 | |
沸点/℃ | 132.2 | 180.5 | 174 |
熔点/℃ | -45.6 | -15 | 53 |
下列说法正确的是
A. 该反应属于取代反应
B. 反应放出的氯化氢可以用水吸收
C. 用蒸馏的方法可将邻二氯苯从有机混合物中首先分离出来
D. 该反应必须在密闭体系中进行
查看答案和解析>>
科目: 来源:辽宁省葫芦岛市高三第一次模拟考试理综化学试卷 题型:选择题
下列图示与对应的叙述相符的是
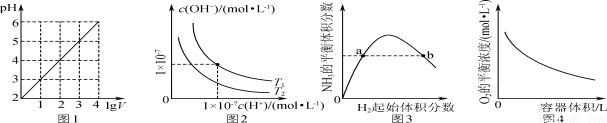
A.图1表示1 L pH=2的CH3COOH溶液加水稀释至V L,pH随lg V的变化
B.图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1
C.图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点
D.图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s) 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
查看答案和解析>>
科目: 来源:辽宁省葫芦岛市高三第一次模拟考试理综化学试卷 题型:选择题
X、Y、Z、M、W为五种短周期元素,X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;丫与M形成的气态化合物在标准状况下的密度为0.76g·L-1; W的质子数是X、Y、Z、M四种元素质子数之和的 ,下列说法正确的是
,下列说法正确的是
A. 原子半径:W>Z>Y>X>M
B. YZ2溶于水形成的溶液具有较强的氧化性
C. 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
D. 1 molWM溶于足量水中完全反应共转移2mol电子
查看答案和解析>>
科目: 来源:辽宁省葫芦岛市高三第一次模拟考试理综化学试卷 题型:选择题
下列实验操作和现象对应所得到的结论均正确的是
选项 | 实验操作和现象 | 结论 |
A | 向某无色溶液中滴加氯水和CCl4,振荡、静置,下层溶液显紫色 | 原溶液中有I- |
B | 向稀HNO3中加入过量的Fe粉,充分反应后,滴入K3[Fe(CN)6]溶液,产生蓝色沉淀 | 稀HNO3将Fe氧化为Fe2+ |
C | 常温下,测定盐酸和醋酸溶液的pH;盐酸pH小于醋酸PH | 证明相同条件下,在水中HCl电离程度大于CH3COOH |
D | 室温下,用pH试纸测得:0.1mol/LNa2SO3溶液的pH约为10;0.1mol/ LNaHSO3溶液的pH约为5 | HSO3-结合H+的能力比SO32-的强 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源:辽宁省葫芦岛市高三第一次模拟考试理综化学试卷 题型:选择题
电化学气敏传感器可用于检测环境中NH3的含量,其工作原理示意图如下。

下列说法不正确的是
A. O2在电极b上发生还原反应
B. 溶液中OH+向电极a移动
C. 负极的电极反应式为:2NH3-6e-+6OH-=N2+6H2O
D. 反应消耗的NH3与O2的物质的量之比为4:5
查看答案和解析>>
科目: 来源:辽宁省葫芦岛市高三第一次模拟考试理综化学试卷 题型:填空题
游离态的氮经一系列转化可以得到硝酸,如下图所示。
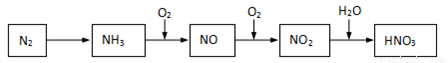
(1)NH3和O2在催化剂作用下反应,其化学方程式是______________。
(2)NO2→HNO3反应中氧化剂和还原剂的物质的量之比为________________。
(3)2NO(g)+O2(g)  2NO2(g)是制造硝酸的重要反应之一。在800℃时,向容积为1L的密闭容器中充入0.010molNO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。
2NO2(g)是制造硝酸的重要反应之一。在800℃时,向容积为1L的密闭容器中充入0.010molNO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。
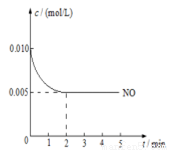
①2min内,v(O2)=________mol/(L·min)
②800℃时,该反应的化学平衡常数为__________。
③判断该反应达到平衡的依据是(写出2条即可)____________。
④已知:ⅰ.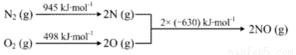
ⅱ.N2(g)+2O2(g)=2NO2(g) ΔH=+68kJ·mol-1,写出NO生成NO2热化学方程式_____________,温度对于NO生成NO2平衡转化率的影响是:___________________。
(4)电解法处理含氮氧化物废气,可以回收硝酸。实验室模拟电解法吸收NO,装置如图所示(均为石墨电极)。请写出电极过程中NO转化为硝酸的电极反应式:______________。
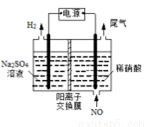
查看答案和解析>>
科目: 来源:辽宁省葫芦岛市高三第一次模拟考试理综化学试卷 题型:填空题
二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。
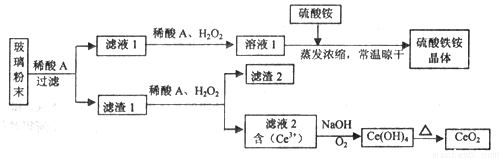
已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1)稀酸A的分子式是_____________________。
(2)滤液1中加入H2O2溶液的目的是__________________。
(3)设计实验证明滤液1中含有Fe2+_____________________。
(4)已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,书写该反应的离子方程式____________。
(5)由滤液2生成Ce(OH)4的离子方程式__________________。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,但其在去除酸性废水中的悬浮物时效率降低,其原因是___________________。
(7)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.l000mol·L-1FeSO 4标准溶液滴定至终点时(铈被还原为Ce3+ ),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质置分数为_______(结果保留两位有效数字)。
查看答案和解析>>
科目: 来源:辽宁省葫芦岛市高三第一次模拟考试理综化学试卷 题型:实验题
碳酸钠、碳酸氢钠是日常生产生活中常用的两种盐。在实验室中制取NaHCO3的方法有多种。请
依据下列方法回答问题:
方法一:模拟工业“侯氏制碱法”制取:(原理NaCl+H2O+CO2+NH3 = NaHCO↓+NH4Cl)
第一步:连接好装置,检验气密性,在仪器内装人药品。
第二步:让某一装置先发生反应,直到产生的气体不能再在Ⅲ中溶解,再通入另一装置中产生的气体,片刻后,Ⅲ中出现固体。继续向Ⅲ中通入两种气体,直到不再有固体产生。
第三步:分离Ⅲ中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的某固体粉末,有NH4Cl晶体析出。

(1)图中所示装置的连接顺序是:a接f;e接________;b接_________(填接口编号)。
(2) I中盛放稀盐酸的仪器名称是_____________,IV中应选用的液体为________________。
(3 )第二步中让 _____________ (填序号)装置先发生反应。
(4)第四步中所加固体粉末为________。所得的晶体中常含有少置的NaCl和NaHCO3(约占5%~8%),请设计一个简单的实验,不使用其他任何试剂,证明所得晶体大部分是NH4Cl。简要写出操作和现象______________________。
方法二:把CO2通人饱和Na2CO3溶液制取NaHCO3。装置如下图所示(气密性已检验,部分夹持装置略):
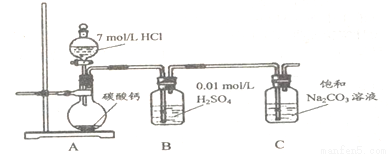
(5 )请结合化学平衡移动原理解释B中溶液的作用_________________。
(6)当C中有大量白色固体析出时,停止实验,将固体过滤、洗涤、干燥备用。为确定固体的成分,实验小组设计方案如下(取一定量的固体,配成溶液作为样液,其余固体备用):
①方案1:取样液与澄清的Ca(OH)2溶液混合,出现白色沉淀。
实验小组对现象产生的原理进行分析,认为该方案不合理,理由是________________。
②方案2:取样液与BaCl2溶液混合,出现白色沉淀并有气体产生。
实验小组认为固体中存在NaHCO3,其离子方程式是________________。
方法三:(7)请你再写出一种实验室制取少量碳酸氢钠的方法(用相关的化学反应方程式来表示):__________________________________。
查看答案和解析>>
科目: 来源:辽宁省葫芦岛市高三第一次模拟考试理综化学试卷 题型:填空题
金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)Ti基态原子的电子排布式为____________。
(2)Ti能与B、C、N、O等非金属元素形成稳定的化合物,B、C、N的电负性由大到小的顺序为_____;C、N、O的第一电离能由大到小的顺序为_____________。
(3)N的氢化物常作制冷剂,原因是______________。
(4)月球岩石—玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。
SO42-的空间构型为_______形。其中硫原子采用_________杂化,写出SO42-的一种等电子体的化学式:______。
(5)Ti、Ca、O相互作用能形成如图晶体结构(Ti4+位于立方体的顶点、Ca2+位于立方体体心),该晶体的化学式为________。Ti4+和周围_____个O2-相紧邻。该晶胞的边长为apm,则其密度为______g/cm3。
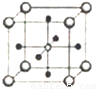
查看答案和解析>>
科目: 来源:辽宁省葫芦岛市高三第一次模拟考试理综化学试卷 题型:推断题
聚对苯二甲酸乙二酯(J)具有良好的力学性能,其薄膜的伸拉强度是聚乙烯薄膜的9倍。它的合成路线如下:

已知:
①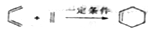
②酯与醇可发生如下酯交换反应:RCOOR′+R〞OH  RCOOR〞+R′OH(R、R′、R〞代表烃基)
RCOOR〞+R′OH(R、R′、R〞代表烃基)
(1)A的产量标志着一个国家石油化工发展水平,反应①的反应类型为______________。
(2)C的分子式是C2H6O2,是汽车防冻液的主要成分。反应②的试剂和反应条件是____________。
(3)D的分子式是C6H6O4,是一种直链结构的分子,核磁共振氢谱有3种峰,D种含有的官能团是______。
(4)F的结构简式是__________________。
(5)反应⑥的化学方程式是_________________。
(6)反应⑦为缩聚反应,反应⑦的化学方程式是_________________。
(7)G是一种同分异构体,G′为甲酸酯,核磁共振氢谱有3种峰且1mol该有机物酸性条件下水解产物能与2molNaOH反应。G′的结构简式为______________。
(8)以对二甲苯、甲醇为起始原料,选用必要的无机试剂合成G,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com