
科目: 来源:福建省2016-2017学年高一3月月考化学试卷 题型:填空题
完成下反应的化学方祝式或离子方程式:
(1)铝与黑色铁的化合物(有磁性)反应_____________。
(2)工业上制粗硅的反应____________。
(3)硫酸铝溶液中加入过量氨水的离子方程式____________。
(4)用稀盐酸清洗铜器皿表面上的铜锈的离子方程式:____________。
查看答案和解析>>
科目: 来源:福建省2016-2017学年高一3月月考化学试卷 题型:填空题
在2008年初我国南方通遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1mol XY2含有54 mol电子。
(1)该融雪剂的化学式是______,X与氢元素形成的化合物与水反应时生成一种强碱和一种单质。写出有关反应的化学方程式___________。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是__________。 D所在族元素的气态氢化物中,最稳定的是____________。
(3)元素W与Y同周期,其单质是良好的半导体材料;元素Z的单质分子Z2是空气的主要成分,常温下非常稳定;W与Z能形成一种新型无机非金属材料.其化学式是________。
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的其中一种产物是OR2。该反应的离子方程式为_____________。
查看答案和解析>>
科目: 来源:福建省2016-2017学年高一3月月考化学试卷 题型:填空题
A、B、C、D、E均为短周期元素,且原子序数依次增大;A的主族序数、周期数、原子序数均相同;B为非金属元素,其单质有多种同素异形体,其中一种可作电极材料;C是植物生长所需的主要元素之一;D和A可形成A2D和A2D2,A2D是最常见的溶剂;E原子次外层电子电子数等于其它层电子数之和。则
(1)E在周期表中的位置是______________,B、C、D、E与A形成的化合物中稳定性最强的是_______(该化学式)。
(2)C、D、E的离子半径由大至小顺序______________。
(3)写出B与由A、C、D组成的化合物的浓溶液在加热条件下的反应方程式:_________。
(4)A-E五种元素中,含同一元素的各类物质能实现下列转化的有______(填元素符号)。
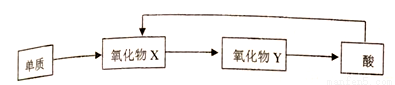
(5)A2D2与FeSO4溶于稀硫酸,反应的离子方程式为_________。
(6)由A、B、C、D四种元素组成的化合物A,其原子个致比为7: 2 : l : 2,则A为(名称)__________。
查看答案和解析>>
科目: 来源:福建省2016-2017学年高一3月月考化学试卷 题型:填空题
(1)某无色透明溶液,加入金属铝反应放出H2,试判断下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、HCO3-、OH-、NO3-在下列两种情况中,可能大量存在于此溶液中的是:
①当与铝反应后,生成Al3+时,原溶液可能存在的离子有______________ ;
②当与铝反应后,生成[Al(OH)4]-时,原溶液可能存在的离子有______________ 。
(2)若向100mL、0.1mol/L硫酸铝溶液中加入0.5mol/L的NaOH溶液,反应后得到1.17g沉淀,则加入的NaOH溶液体积为_________。
(3)在200mL、0.2mol/LNa[Al(OH)4]溶液中逐滴加入0.2mol/LH2SO4溶液250mL,试回答:
①写出分两步反应的离子方程式:_______、________。
②反应完全后,溶液中SO42-离子与Al3+离子的物质的量之比为________。
查看答案和解析>>
科目: 来源:福建省2016-2017学年高一3月月考化学试卷 题型:实验题
某化学课外兴趣小组探究铜与浓硫酸的反应情况.甲.乙.丙三位同学进行了下列实验:取12.8g铜片和20ml.18mol/L的浓硫酸放在圆底烧瓶中共热,直至反应完毕,最后发现烧瓶中还有铜片剩余外,同时根据所学的知识认为还有较多的硫酸剩余.
(1)请写出铜跟浓硫酸反应的化学方程式: ,
试问:为什么较多的余酸不再与铜片继续反应?简述理由: .
可以证明有余酸的实验方案是 (填写字母,错选或多选扣分).
a.再加入铁粉 b.再滴入BaCl2溶液
c.再加入银 d.再滴入Na2CO3溶液
(2)甲学生设计求余酸浓度的实验方案是测定产生气体的量.其方法有多种,请问下列方案中不可行的是 (填写字母,错选或多选扣分).
a.将产生的气体缓缓通过预先称量盛有碱石灰的干燥管,结束反应后再次称量.
b.将产生的气体缓缓通入酸性高锰酸钾溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀.
c.用排水法测定其产生气体的体积(折算成标准状况).
d.用排饱和NaHSO3溶液的方法测出其产生气体的体积(折算成标准状况).
(3)乙同学设计测定余酸浓度的实验方案是:测定反应后的混合液中Cu2+的量.在反应后的溶液中加蒸馏水稀释至100ml,加入足量Na2S溶液,充分反应后,过滤.洗涤.干燥、称量沉淀.请写出生成沉淀的离子方程式: .
(4)根据甲、乙两同学的实验方案,除测算产生气体的物质的量或反应掉的铜的物质的量外,尚缺少的测量数据是 .
(5)丙同学提出甲、乙两同学的实验方案设计的复杂,为此他设计了下列较为简易的实验方案:取出反应后的铜片,进行洗涤.干燥.称量.若称得剩余铜片的质量为Wg,测得反应后溶液的体积为Vml,请计算剩余硫酸的物质的量浓度= mol/L(用含W.V的代数式表示)
查看答案和解析>>
科目: 来源:2017届浙江省教育绿色评价联盟高三3月适应性考试(选考)化学试卷(解析版) 题型:选择题
下列化合物中,属于酸性氧化物的是( )
A. MgO B. SO2 C. H2SO4 D. CO
查看答案和解析>>
科目: 来源:2017届浙江省教育绿色评价联盟高三3月适应性考试(选考)化学试卷(解析版) 题型:选择题
下列物质属于非电解质的是( )
A. 石墨 B. HCl C. CO2 D. BaCO3
查看答案和解析>>
科目: 来源:2017届浙江省教育绿色评价联盟高三3月适应性考试(选考)化学试卷(解析版) 题型:选择题
反应2Na +2H2O=2NaOH+H2↑中的还原剂是( )
A. Na B. H2O C. NaOH D. H2
查看答案和解析>>
科目: 来源:2017届浙江省教育绿色评价联盟高三3月适应性考试(选考)化学试卷(解析版) 题型:选择题
下列物质的水溶液因水解而呈碱性的是
A.NaCl B.NH4Cl C.NaHCO3 D.NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com