
科目: 来源:江苏省淮安市2017届高三第三次调研测试化学试卷 题型:选择题
根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向碳酸钠溶液中加入浓盐酸,将产生的气体通入苯酚钠溶液中,溶液变浑浊 | 酸性:碳酸>苯酚 |
B | 向1mL 0.1 mol·L-1 MgSO4溶液中,滴入2滴0.1 mol·L-1 NaOH溶液,产生白色沉淀,再滴入2滴0.1 mol·L-1CuSO4溶液,白色沉淀逐渐变为蓝色 | Ksp[Cu(OH)2]< Ksp[Mg(OH)2] |
C | 向蛋白质溶液中加入甲醛溶液和Na2SO4饱和溶液,均产生白色沉淀 | 蛋白质均发生了变性 |
D | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色 | 该溶液是钠盐溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源:江苏省淮安市2017届高三第三次调研测试化学试卷 题型:选择题
H2S为二元弱酸。20℃时,向 0.100 mol·L-1的Na2S溶液中缓慢通入HCl气体(忽略溶液体积的变化及H2S的挥发)。下列指定溶液中微粒的物质的量浓度关系一定正确的是
A. 通入HCl气体之前:c(S2-)>c(HS-)>c(OH-)>c(H+)
B. pH=7的溶液中:c(Cl-)=c(HS-)+2c(H2S)
C. c(HS-)=c(S2-)的碱性溶液中:c(Cl-)+c(HS-)>0.100 mol·L-1+c(H2S)
D. c(Cl-)=0.100 mol·L-1的溶液中:c(OH-)-c(H+)=c(H2S)-c(S2-)
查看答案和解析>>
科目: 来源:江苏省淮安市2017届高三第三次调研测试化学试卷 题型:选择题
两个容积均为2L的密闭容器Ⅰ和Ⅱ中发生反应:2NO(g)+2CO(g) N2(g)+2CO2(g),起始物质的量见下表。实验测得两容器不同温度下达到平衡时CO2的物质的量如下图所示,下列说法正确的是
N2(g)+2CO2(g),起始物质的量见下表。实验测得两容器不同温度下达到平衡时CO2的物质的量如下图所示,下列说法正确的是

A. N点的平衡常数为0.04
B. M、N两点容器内的压强:P(M)>2P(N)
C. 若将容器Ⅰ的容积改为1 L,T1温度下达到平衡时c(CO2)=0.25 mol·L-1
D. 若将容器Ⅱ改为绝热容器,实验起始温度为T1,达平衡时NO的转化率小于16.7%
查看答案和解析>>
科目: 来源:江苏省淮安市2017届高三第三次调研测试化学试卷 题型:实验题
工业上利用氧化铝基废催化剂(主要成分为Al2O3,少量Pd)回收Al2(SO4)3及Pd的流程如下:

⑴焙烧时产生的气体X为_____________(填化学式)。
⑵浸液Y的主要成分为_____________(填化学式)。
⑶“热还原”过程中发生反应的化学方程式为____________。
⑷上述流程中焙烧温度不宜过高,否则会导致硫酸铵固体的分解。某兴趣小组为探究高温下硫酸铵的分解产物,通过下列装置进行实验,观察到B中溶液颜色变浅,C中无明显现象。
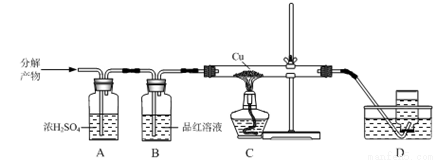
①装置B的作用是_____________。
②进一步测定可知,D中收集到的气体相对分子质量为28。写出(NH4)2SO4固体高温分解的化学方程式:_____________。
⑸Pd是优良的储氢金属,其储氢原理为2Pd(s)+x H2(g)=2PdHx(s),其中x的最大值为0.8。已知:Pd的密度为12g·cm-3,则1cm3Pd能够储存标准状况下H2的最大体积为
_____________L(计算结果保留整数)。
查看答案和解析>>
科目: 来源:江苏省淮安市2017届高三第三次调研测试化学试卷 题型:推断题
化合物F是一种最新合成的溶瘤药物,可通过以下方法合成:

⑴F中所含官能团名称为_____________。
⑵A→B的反应类型是_____________。
⑶C的结构简式为_____________。
⑷写出同时满足下列条件的 的一种同分异构体G的结构简式:
的一种同分异构体G的结构简式:
_____________。
①G分子中有4种不同化学环境的氢;
②G的水解产物均能发生银镜反应,其中一种产物还能与FeCl3溶液发生显色反应。
⑸请写出以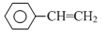 、(C6H5)3P为原料制备化合物
、(C6H5)3P为原料制备化合物 的合成路线流程图________(无机试剂任选,合成路线流程图示例见本题题干)。
的合成路线流程图________(无机试剂任选,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目: 来源:江苏省淮安市2017届高三第三次调研测试化学试卷 题型:实验题
纳米材料镍粉(Ni)是一种高性能电极材料。其制备过程如下:
步骤I:取0.2 mol·L-1的硝酸镍溶液,调节pH除铁后,加入活性炭过滤。
步骤Ⅱ:向所得滤液中滴加1.5mol·L-1的NaHCO3溶液使Ni2+完全沉淀,生成xNiCO3·yNi(OH)2·zH2O。
步骤Ⅲ:将产生的沉淀用大量高纯水清洗并用离心机甩干。
步骤Ⅳ:加入稍过量的肼溶液(N2H4·H2O),使上述沉淀还原完全,将生成的Ni水洗后,再用95%的乙醇浸泡后晾干。
⑴步骤I中去除杂质Fe3+(使其浓度<10-6 mol·L-1),需调节溶液pH的范围为___________。(Ksp[Ni(OH)2]=2×10-15,Ksp[Fe(OH)3]=1×10-39)
⑵当x:y:z=1:1:1时,写出步骤Ⅱ中产生沉淀的离子方程式:___________。
⑶步骤Ⅳ中采用95%的乙醇浸泡的目的是___________。
⑷为测定xNiCO3·yNi(OH)2·zH2O的组成,进行如下实验:
①准确称取7.54 g样品与过量的肼溶液(N2H4·H2O)充分反应,共收集到1.12 LN2和CO2混合气体(已换算成标准状况)。
②另取等质量的样品充分灼烧,冷却后称得残留固体NiO的质量为4.5g。
通过计算确定xNiCO3·yNi(OH)2·zH2O的化学式__________(写出计算过程)。
查看答案和解析>>
科目: 来源:江苏省淮安市2017届高三第三次调研测试化学试卷 题型:实验题
实验室以一种工业废渣(含80%~90%的Ca(OH)2,其余为焦炭等不溶物)为原料制备KClO3的实验过程如下:

几种物质的溶解度如下图:
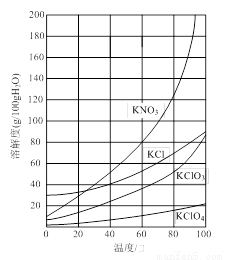
⑴反应I的目的是制备Ca(ClO3)2,写出该反应的化学方程式:_____________;在通入Cl2和O2比例、废渣量均一定的条件下,为使Cl2转化完全,可采取的合理措施是____________。
⑵若过滤时滤液出现浑浊,其可能的原因是_____________(填序号)。
A.漏斗中液面高于滤纸边缘 B.滤纸已破损 C.滤纸未紧贴漏斗内壁
⑶所加试剂Y选用KCl而不用KNO3的原因是_____________。
⑷已知:4KClO3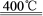 3KClO4 +KCl;2KClO3
3KClO4 +KCl;2KClO3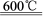 2KCl+3O2↑。实验室可用KClO3制备高纯KClO4固体,实验中必须使用的用品有:热过滤装置(如下图所示)、冰水。
2KCl+3O2↑。实验室可用KClO3制备高纯KClO4固体,实验中必须使用的用品有:热过滤装置(如下图所示)、冰水。
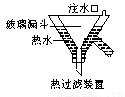
①热过滤装置中玻璃漏斗的下端露出热水浴部分不宜过长,其原因是_____________。
②请补充完整由KClO3制备高纯KClO4固体的实验方案:
向坩埚中加入一定量的KClO3,_____________,在低温下干燥得KClO4固体。
查看答案和解析>>
科目: 来源:江苏省淮安市2017届高三第三次调研测试化学试卷 题型:填空题
SO2和氮氧化物的转化和综合利用既有利于节约资源,又有利于保护环境。
⑴H2还原法是处理燃煤烟气中SO2的方法之一。已知:
2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=a kJ·mol—1
H2S(g)= H2(g)+S(s) ΔH=b kJ·mol—1
H2O(l)= H2O(g) ΔH=c kJ·mol—1
写出SO2(g)和H2(g)反应生成S(s)和H2O(g)的热化学方程式:_____________。
⑵20世纪80年代Townley首次提出利用电化学膜脱除烟气中SO2的技术:将烟气预氧化使SO2转化为SO3,再将预氧化后的烟气利用如图所示原理净化利用。

①阴极反应方程式为_____________。
②若电解过程中转移1mol电子,所得“扫出气”用水吸收最多可制得质量分数70%的硫酸_____________g。
⑶利用脱氮菌可净化低浓度NO废气。当废气在塔内停留时间均为90s的情况下,测得不同条件下NO的脱氮率如图Ⅰ、Ⅱ所示。



图Ⅰ 图Ⅱ 图Ⅲ
①由图I知,当废气中的NO含量增加时,宜选用____________法提高脱氮效率。
②图Ⅱ中,循环吸收液加入Fe2+、Mn2+提高了脱氮的效率,其可能原因为_____________。
⑷研究表明:NaClO2/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。图Ⅲ所示为复合吸收剂组成一定时,温度对脱硫脱硝的影响。
①温度高于60℃后,NO去除率随温度升高而下降的原因为_____________。
②写出废气中的SO2与NaClO2反应的离子方程式:____________。
查看答案和解析>>
科目: 来源:江苏省淮安市2017届高三第三次调研测试化学试卷 题型:填空题
元素X、Y、Z为前四周期元素,X的基态原子核外电子有21种运动状态,元素Y的原子最外层电子数是其内层的3倍,Z与X、Y不在同一周期,且Z原子核外p电子比s电子多5个。
⑴X基态原子的核外电子排布式为___________。
⑵X是石油化工中重要的催化剂之一,如催化异丙苯( )裂化生成苯和丙烯。
)裂化生成苯和丙烯。
①1 mol苯分子中含有σ键的数目为_____________mol。
②异丙苯分子中碳原子轨道的杂化类型为_____________。
⑶与Y3分子互为等电子体的阳离子为_____________。
⑷XZ3易溶于水,熔点为960℃,熔融状态下能够导电,据此可判断XZ3晶体属于
_____________(填晶体类型)。
⑸元素Ce与X同族,其与Y形成的化合物晶体的晶胞结构如下图,该化合物的化学式为_____________。

查看答案和解析>>
科目: 来源:江苏省淮安市2017届高三第三次调研测试化学试卷 题型:实验题
2—叔丁基对苯二酚是一种重要的食品抗氧剂,现以对苯二酚、叔丁醇为原料,一定条件下经Freidel-Crafts 烷基化反应合成。原理如下:
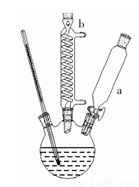

步骤Ⅰ:连接如右图所示装置。
步骤Ⅱ:向三颈烧瓶中加入4.0g 对苯二酚,15mL 浓磷酸,15mL甲苯,启动搅拌器,油浴加热混合液至90℃。从仪器a缓慢滴加 3.5mL叔丁醇,使反应温度维持在 90℃~95℃,并继续搅拌 15min 至固体完全溶解。
步骤Ⅲ:停止搅拌,撤去热浴,趁热转移反应液至分液漏斗中,将分液后的有机层转移到三颈烧瓶中,加入 45mL 水进行水蒸气蒸馏,至无油状物蒸出为止。
步骤Ⅳ:把残留的混合物趁热抽滤,滤液静置后有白色晶体析出,
最后用冷水浴充分冷却,抽滤,晶体用少量冷水洗涤两次,压紧、抽干。
⑴图中仪器a的名称为_____________;仪器b的作用是_____________。
⑵步骤Ⅱ中所加入物质中,有一种物质是催化剂,其化学式为_____________。
⑶已知:叔丁醇熔点是 25℃~26℃,常温下是固体。实验时加入叔丁醇的方法是
_____________。
⑷制备过程应严格控制反应温度90℃~95℃,其原因是_____________。
⑸2—叔丁基对苯二酚粗产品久置会变红,其原因是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com