
科目: 来源:2016-2017学年安徽省淮北市高二下学期第一次月考化学试卷(解析版) 题型:选择题
向0.1mol/I.的NH4HCO3溶液中逐渐加入0.1mol/LNaOH溶液时,含氮、含碳粒子的分布情况如图所示(纵坐标是各粒子的分布系数,即物质的量分数)。根据图象,下列说法不正确的是( )

A.开始阶段,HCO3-反而略有增加,可能是因为NH4HCO3溶液中存在H2CO3发生的主要反应是H2CO3+OH-═HCO3-+H2O
B.当pH大于8.7以后,碳酸氢根离子和铵根离子同时与氢氧根离子反应
C.pH=9.5时,溶液中c(HCO3-)>c(HN3•H2O)>c(NH4+)>c(CO32-)
D.滴加氢氧化钠溶液时,首先发生的反应为2NH4HCO3+2NaOH═(NH4)2CO3+Na2CO3
查看答案和解析>>
科目: 来源:2016-2017学年安徽省淮北市高二下学期第一次月考化学试卷(解析版) 题型:选择题
2015年10月5日,中国著名药学家屠呦呦获得诺贝尔奖生理学或医学奖,获奖理由是“因为发现青蒿素—一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”。青蒿素是从植物黄花蒿茎 叶中提取的,其结构简式如右图,下列说法不正确的是

A.该分子中有6个手性碳原子
B.它的分子式为C15H2205
C.因其具有过氧基团,它不稳定,易受湿、热和还原性物质的影响而变质
D.它在常见有机溶剂中的溶解度大于在水中的溶解度
查看答案和解析>>
科目: 来源:2016-2017学年安徽省淮北市高二下学期第一次月考化学试卷(解析版) 题型:选择题
美国科学家合成了含有N5+的盐类,含有该离子的盐是高能爆炸物质,该离子的结构呈V 形,如图所示(图中箭头代表单键)。下列有关该物质的说法中正确的是

A. 每个Ns+中含有35个质子和36个电子 B. 该离子中只含有非极性键
C. 该离子中含有2个π键 D. N5+与PO43-互为等电子体
查看答案和解析>>
科目: 来源:2016-2017学年安徽省淮北市高二下学期第一次月考化学试卷(解析版) 题型:选择题
有五种元素X、Y、Z、Q、T。X元素为主族元素,X原子的M层上有两个未成对电子且无空轨道;Y原子的特征电子构型为3d64S2;Z原子的L电子层的p能级上有一介空轨道;Q原子的L电子层的P能级上只有一对成对电子;T原子的M电子层上p轨道半充满。下列叙述不正确的是
A. 元素Y和Q可形成化合物Y2Q3
B. X与T的最高价氧化物对应的水化物,前者的酸性比后者强
C. X和Q结合生成的化合物为离子化合物
D. ZQ2是极性键构成的直线形分子
查看答案和解析>>
科目: 来源:2016-2017学年安徽省淮北市高二下学期第一次月考化学试卷(解析版) 题型:简答题
周期表前四周期的元素a、b、c、d、e原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)e的价层电子排布式为__________。b、c、d三种元素中第一电离能最大的是_____(填元素名称);
(2)a和其他四种元素形成的二元共价化合物分子中既含有极性共价键、又含有非极性共价键的化合物是 __________(填化学式,写出两种);
(3)这五种元素的原子中有的能形成含氧酸,三角锥结构的酸是__________(填化学式);酸根是___________
(4)写出由这五种元素中的某些原子构成的,与3个c原子构成的分子互为等电子体的微粒_____(填化学式,写出两种)。
查看答案和解析>>
科目: 来源:2016-2017学年安徽省淮北市高二下学期第一次月考化学试卷(解析版) 题型:简答题
氨气在生产、生活和科研中应用十分广泛。
(1)以CO2与NH3为原料合成尿素的主要反应如下:
2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159kJ·mol-1
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+72kJ·mol-1
H2O(l)=H2O(g) △H=+44kJ·mol-1
则反应2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l) △H=______kJ·mol-1
(2)某温度下,向容积为100 ml的密闭容器中通入4molNH3和2molCO2发生反应2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g),物质X的浓度变化曲线如下图所示。
CO(NH2)2(s)+H2O(g),物质X的浓度变化曲线如下图所示。

①前5s内,v(H2O)=__________。
②该条件下的平衡常数K=_______。
(3)T℃时,将等物质的量的NO和CO充入体积为2L的密闭容器中,保持温度和体积不变,反应过程(0——15min)中NO的物质的量随时间的变化如图所示。
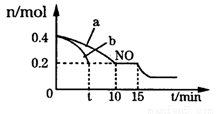
①平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,平衡将____(填“向左”“向右”或“不”)移动。
②图中a、b分别表示在一定温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是______(填“a”或“b”)。
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是____。
(4)垃圾渗滤液中含有大量的氨氮物质(用NH3表示)和氯化物,把垃圾渗滤液加入如图所示的电解池(电极为惰性材料)中进行电解除去NH3,净化污水。该净化过程分两步:第一步电解产生氧化剂,第二步氧化剂氧化氨氮物质生成N2。

①写出第二步反应的化学方程式_________。
②若垃圾渗滤液中氨氮物质的含量为1.7%,则理论上电解1t该污水,电路中转移的电子数为________。
查看答案和解析>>
科目: 来源:2016-2017学年安徽省淮北市高二下学期第一次月考化学试卷(解析版) 题型:填空题
(NH4)2Fe(SO4)2•6H2O(莫尔盐,浅绿色,式量392)在定量分析中常用作标定高锰酸钾、重铬酸钾等溶液的标准物质,还用作化学试剂、医药以及用于冶金、电镀等。
回答下列问题:
(1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置于空气中也会变质,检验莫尔盐是否变质的试剂是________;
(2)准确称取mg纯净的莫尔盐,在锥形瓶中加人20mL水充分溶解,用某酸性K2Cr2O7溶液滴定至终点.重复进行3次,测得有关数据如下:
实验序号 | 起始读数/mL | 终点读数/mL |
I | 2.50 | 22.58 |
Ⅱ | 1.00 | 23.12 |
Ⅲ | 0.00 | 19.92 |
①K2Cr2O7溶液应该放在________式滴定管中.
②写出滴定过程中反应的离子方程式:________;
③所测K2Cr2O7溶液的物质的量浓度为________mol/L(用含M的代数式表示)
(3)某课题组通过实验检验莫尔盐晶体加热时的分解产物。
①甲同学提出猜想:分解产物可能是N2、Fe2O3,SO3、H2O四种物质.你是否同意并说明理由:________;
②乙同学设计了如图装置,其中A装置中的固体变为红棕色,则固体产物中含有________;C装置中红色褪去,说明气体产物中含有________;C装置后应连接尾气吸收装置D,D中盛有的试剂可以是________(写一种即可)。

③丙同学想利用上述装置证明分解产物中含有氨气.只需更换B,C中的试剂即可,则更换后的试剂为B________、C________;
④丁同学认为莫尔盐分解可能会生成N2,SO3,拟从下列装置如图2中选择必要的装置加以证明.则正确的连接顺序从左到右依次是A、________。

查看答案和解析>>
科目: 来源:2016-2017学年安徽省淮北市高二下学期第一次月考化学试卷(解析版) 题型:实验题
二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeFCO3)为原料制备 CeO2的一种工艺流程如下:

已知:①Ce4+能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2 ]萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是_____________。
(2)“酸浸”中会产生大量黄绿色气体,写出CeO2与盐酸反应的离子方程式:____________;为避免产生上述污染,请提出一种解决方案:_____________。
(3)“萃取”时存在反应:Ce4+ +n(HA)2 Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为____________;下图中D时分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(
Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为____________;下图中D时分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比( )。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:__________。
)。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:__________。

(4)“反萃取”中,在稀硫酸和H2O2的作用下CeO2转化为Ce3+。H2O2在该反应中作_________(填“催化剂”“氧化剂”或“还原剂”),每有1molH2O2参加反应,转移电子的物质的量为__________。
(5)“氧化”步骤的化学方程式为_____________。
(6)取上述流程中得到的CeO2产品0.4500 g,加硫酸溶解后,用0.1000mol/LFeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其他杂质均不反应),消耗25.00 mL标准溶液。该产品中CeO2的质量分数为_________。
查看答案和解析>>
科目: 来源:2017届江苏省南通市高三高考全真模拟(二)化学试卷(解析版) 题型:选择题
《中华人民共和国安全生产法》指出安全生产工作应当以人为本,坚持安全发展、预防为主、综合治理的方针。下列做法不正确的是( )
A. 面粉生产车间应严禁烟火 B. NH3泄露时向空中喷洒水雾
C. 含Cl2的尾气用碱溶液处理后再排放 D. 金属钠失火时应立即用大量冷水扑灭
查看答案和解析>>
科目: 来源:2017届江苏省南通市高三高考全真模拟(二)化学试卷(解析版) 题型:选择题
下列有关钠元素及其化合物的表示正确的是( )
A. 钠原子的结构示意图: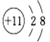
B. 过氧化钠的电子式: 
C. 小苏打在水中的电离方程式:NaHCO3=Na++HCO3-
D. 硫化钠的水溶液呈碱性的原因:S2-+2H2O H2S+2OH-
H2S+2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com