
科目: 来源:2017届黑龙江省哈尔滨市高三二模理科综合化学试卷(解析版) 题型:选择题
聚甲基丙烯酸甲脂的缩写代号为PMMA,俗称有机玻璃,其单体的分子式为C5H8O2。下列说法正确的是
A. 合成PMMA的单体是甲基丙烯酸和甲醇
B. 合成PMMA的单体可以发生加成反应、取代反应、缩聚反应
C. C5H8O2属于羧酸的结构共有7种
D. C5H8O2某种结构中碳原子可能都处于同一平面
查看答案和解析>>
科目: 来源:2017届黑龙江省哈尔滨市高三二模理科综合化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W、R的原子序数依次增大,Y原子达到稳定结构获得的电子数目和它的内层电子数目相等,X与Z同主族,Z是所在周期主族元素中原子半径最大的元素,W的最外层电子数与电子层数相同,R与Z形成的化合物其水溶液呈碱性。下列说法正确的是
A. 离子半径由大到小的顺序为R、Z、Y、W
B. X、Y分别与Z形成的多种化合物在化学键类型都相同
C. 由X、Y、Z、R四种元素形成的两种化合物在水中不能发生反应
D. Z、W、R最高价氧化物对应的水合物两两之间均能发生反应
查看答案和解析>>
科目: 来源:2017届黑龙江省哈尔滨市高三二模理科综合化学试卷(解析版) 题型:选择题
如图是一种锂钒氧化物热电池装置,电池总反应为xLi+LiV3O8=Li1+xV3O8。工作时,需先引发铁和氯酸钾反应使共晶体熔化,下列说法不正确的是

A. 组装该电池应当在无水、无氧的条件下进行
B. 整个过程的能量转化涉及化学能转化为热能和电能
C. 放电时LiV3O8电极反应为:xLi++LiV3O8-xe-=Li1+xV3O8
D. 充电时Cl?移向LiV3O8电极
查看答案和解析>>
科目: 来源:2017届黑龙江省哈尔滨市高三二模理科综合化学试卷(解析版) 题型:选择题
常温下,用浓度为0.1000mol/L的盐酸分别逐滴加入到20.00mL 0.1000mol/L的两种一元碱MOH、ROH溶液中,PH随盐酸溶液体积的变化如图所示。下列说法正确的是

A. PH=10时,c(M+)>c(MOH)>c(Cl-)>c(OH-)>c(H+)
B. 将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时:c(R+)>c(M+)>c(H+)>c(OH-)
C. 10mL<V(HCl)<20mL时,c(M+)+c(NOH)<c(Cl-)
D. V(HCl)>20mL时,不可能存在:c(Cl-)>c(M+)=c(H+)>c(OH-)
查看答案和解析>>
科目: 来源:2017届黑龙江省哈尔滨市高三二模理科综合化学试卷(解析版) 题型:填空题
硫的多种化合物在工业中有重要应用。
(1)Na2S2可以做制革工业中原皮的脱毛剂,写出Na2S2的电子式______________。
(2)连二亚硫酸钠(Na2S2O4)又称保险粉,可作木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性。
①Na2S2O4中S元素的化合价为_____________
②将甲酸(HCOOH)和NaOH溶液混合,再通入SO2气体,会得到保险粉,此时甲酸被氧化为CO2,该反应的化学方程式为_________________。
③Na2SO4暴露于空气中易吸收氧气和水蒸气而变质,发生反应时,当氧化剂和还原剂的物质的量之比为1:2时,反应的化学方程式为____________。
(3)铬会造成环境污染,某酸性废水中含有Cr2O72-,处理时可用焦亚硫酸钠(Na2S2O5)将Cr2O72-转化为毒性较低的Cr3+,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中Cr3+浓度为0.52mg/L,达到排放标准。
①写出Na2SO5参加反应的离子方程式_______________________。
②处理后的废水中Cr3+的物质的量浓度为____________________。
(4)氢硫酸和亚硫酸是两种弱酸,回答下列问题
①0.1mol/L H2SO4与0.2mol/L H2S溶液等体积混合,所得溶液中S2-浓度为_____mol/L。(已知氢硫酸Ka1=1.0×10-8、Ka2=1.0×10-15,忽略H2S和H2O电离产生的H+)
②已知亚硫酸的Ka1=1.0×10-2、Ka2=6.0×10-13,设计实验证明亚硫酸第一步不完全电离。(可用实验用品:0.1mol/L亚硫酸、0.1mol/L NaHSO3溶液、0.1mol/L Na2SO3溶液,广泛pH试纸、pH计)
操作简述 | ______________ |
现象或数据 | ______________ |
结论 | H2SO3第一步不完全电离 |
查看答案和解析>>
科目: 来源:2017届黑龙江省哈尔滨市高三二模理科综合化学试卷(解析版) 题型:填空题
金属镓是一种广泛用于电子工业和通讯领域的重要金属,化学性质与铝元素相似。
(1)工业上提纯镓的方法很多,其中以电解精炼法为多。具体原理如下:以待提纯的粗镓(内含Zn、Fe、Cu杂质)为阳极,以高纯镓为阴极,以NaOH水溶液为电解质溶液。在电流作用下使粗镓在阳极溶解进入电解质溶液,并通过某种离子迁移技术到达阴极并在阴极放电析出高纯镓。
①已知离子氧化性顺序为:Zn2+<Ga3+<Fe2+<Cu2+。电解精炼镓时阳极泥的成分是_________________。
②GaO2-在阴极放电的电极方程式是_______________________。
(2)工业上利用柜台Ga与NH3高温条件下合成固体半导体材料氮化镓(GaN)同时又有氢气生成。反应中每生成3mol H2时就会放出30.8kJ热量。
①该反应的热化学方程式为__________________。
②一定条件下,加入一定量的Ga与NH3进行上述反应,下列叙述符合事实且可作为判断反应已达到平衡状态的标志的是_________________。
A.恒温恒压下,混合气体的密度不变
B.断裂3molH-H键,同时断裂2molN-H键
C.恒温恒压下达平衡,加入2molH2使平衡移动,NH3的消耗速率等于原平衡时NH3的消耗速率
D.升高温度,氢气的生成速率先增大再减小,最后不变
(3)在密闭容器中,充入一定量的Ga与NH3发生反应,实验测得反应平衡体系中NH3的体积分数与压强的关系曲线如图1所示。


①比较图1中A点和C点化学平衡常数的大小关系:K1A1________________K1C1,(填“<”、“=”或“>”),理由是________________________________
②在T1和P6的条件下,往密闭容器中充入2molNH3和足量的Ga,该反应在第5min时达到平衡,此时容器的体积为3L。
a.若温度保持T1℃不变,压强恒定在P7的条件下重新达到平衡状态A(P7、50%)时,容器的体积变为起始体积的______________倍。
b.若T1和P6条件下反应至3min时刻,改变条件并与D点处达到平衡,H2的浓度随反应时间的变化趋势如图2所示(3~4min的浓度变化未表示出来),则改变的条件为_________(仅改变温度或压强中的一种)
(4)在工业上利用N2(g)+3H2(g)  2NH3(g)合成氮气。对于气相反应,用某组份(B)的平衡压强(PB)代替物质的量浓度(CB)也可以表示平衡常数(记作Kp),且PB=P×B的体积分数。则该反应的化学平衡常数表达式(Kp)是_____。恒温恒压下,在一容积可变的容器中,该反应达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3molN2,则平衡_________移动(填“正向”、“逆向”或“不”)。
2NH3(g)合成氮气。对于气相反应,用某组份(B)的平衡压强(PB)代替物质的量浓度(CB)也可以表示平衡常数(记作Kp),且PB=P×B的体积分数。则该反应的化学平衡常数表达式(Kp)是_____。恒温恒压下,在一容积可变的容器中,该反应达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3molN2,则平衡_________移动(填“正向”、“逆向”或“不”)。
查看答案和解析>>
科目: 来源:2017届黑龙江省哈尔滨市高三二模理科综合化学试卷(解析版) 题型:实验题
某学生欲探究FeSO4溶液与浓HNO3的反应。
该同学向盛有FeSO4溶液的试管中滴入数滴浓硝酸,并振荡试管,预期现象为试管中会立即产生红棕色气体,溶液焰色逐渐变黄。但实际操作时观察到液面上方气体变化红棕色,且试管中溶液颜色变为深棕色。
为了进一步探究溶液变为深棕色的原因,该同学进行如下实验。
回答下列问题
(1)向FeSO4溶液和反应后溶液中加入KSCN溶液,前者不变红色,后者变红,该现象的结论是________。
(2)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe2+或Fe3+发生反应而得到的。为此他利用如图装置(气密性已检验,尾气处理装备略)进行探究。

Ⅰ.打开活塞a、关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化。
Ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应。
Ⅲ.为与Ⅰ中实验进行对照重新更换丙、丁后,使甲中反应重复进行步骤Ⅰ实验,观察到的现象与步骤Ⅰ中相同。
①铜与足量浓硝酸反应的离子方程式是_______________。
②装置乙的试剂为____________________。
③步骤Ⅱ的目的是_______________________。
④该实验可得出的结论是______________________。
(3)该同学重新进行FeSO4溶液与浓HNO3的反应的实验,观察到了预期现象,其实验操作是_________,反应的离子方程式为___________________
查看答案和解析>>
科目: 来源:2017届黑龙江省哈尔滨市高三二模理科综合化学试卷(解析版) 题型:填空题
(1)下列有关说法正确的是_________________。
A.用金属的电子气理论能合理地解释金属易腐蚀的原因
B.手性催化剂只催化或者主要催化一种手性分子的合成
C.草酸二甲酯分子中σ键和π键个数比为6:1
D.MgCO3的热稳定性强于BaCO3
E.根据火山喷出的岩浆中冷却时ZnS比HgS先析出,能判断ZnS的晶格能大于HgS
(2)已知SbCl3、SbCl5、SnCl4的熔点依次为73.5℃、2.8℃、-33℃。依据上述实验事实回答:
①SnCl4中Sn的杂化类型为________,SbCl5的晶体类型为_______,SbCl3的空间构型为____________。
②实验测得在极性溶剂中SbCl5的溶解度比SbCl3的溶解度小得多,其主要原因是___________。
(3)人们一直致力于人工固氮的研究,以获得廉价的氮肥。科学家先后提出并合成了固氮酶的多种模拟物。其中一类是含Mo(钼)、Fe、S原子的类立方体结构,如下图所示:

图中所有实线均代表化学键,左右两边对称,各含一个类立方体的结构。每个类立方体含有4个Fe原子、4个S原子,它们位于立方体的8分顶点,且同种原子不相邻。(已知元素电负性分别为:S—2.5 Fe—1.8 Mo—1.8)
①Mo与Cr是同族元素,并且位于相邻周期,写出基态Mo原子的价电子的轨道表达式为_____________。
②钼是一种人体必需的微量元素。工业上可用辉钼矿(MoS2)焙烧除硫得三氧化钼,写出该过程的化学方程式___________________。
③上述一个类立方体中4个Fe原子所在的顶点连接所构成的空间几何体为_____________。
④在类立方体结构中,一种最近的S原子和S原子间距离为apm,该结构的密度为_______g/cm3(已知NA,只需列式,无需化简)。
查看答案和解析>>
科目: 来源:2017届黑龙江省哈尔滨市高三二模理科综合化学试卷(解析版) 题型:填空题
可降解聚合物G可由芳香烃A通过如下途径制备,质谱法测定A相对分子质量为102。
已知:①B为高分子化合物,D的化学式为C8H10O2
②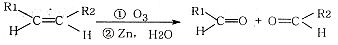
③碳碳双键的碳上连有羟基的有机物不稳定
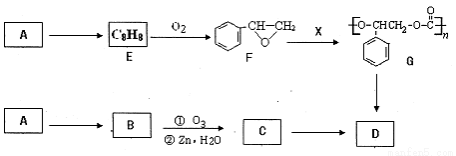
(1)A的化学式为_________,X的化学式为_____________;
(2)写出B的结构简式 。
(3)写出C→D的化学方程式 。
(4)G 在一定条件下水解得到D,写出G→D的化学方程式 。
(5)同时符合下列条件F的稳定同分异构体共 种,写出其中一种结构简式 。
①遇FeCl3不显紫色,除苯环外不含其它环状结构;
②苯环上有三种不同化学环境的氢原子; ③不能发生银镜反应。
查看答案和解析>>
科目: 来源:2017届河南省豫南九校高三下学期质量考评七理综化学试卷(解析版) 题型:选择题
化学与生产、生活密切相关,下列说法正确的是
A. 将煤通过物理变化液化后再作为能源,可减少PM2.5引起的危害
B. 重金属盐可使蛋白质变性,所以吞服“钡餐”会引起中毒
C. 光导纤维属于无机非金属材料,有机玻玻属于新型无机非金属材料
D. 外形似海绵、密度小、有磁性的碳与石墨互为同素异形体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com