
科目: 来源: 题型:
【题目】高纯MnCO3是广泛用于电子行业的强磁性材料。MnCO3为白色粉末,不溶于水和乙醇(沸点78.5 ℃),在潮湿环境下易被氧化,温度高于100 ℃开始分解。
I.实验室以MnO2为原料制备MnCO3
(1)制备MnSO4溶液:
①主要反应装置如图所示,缓缓通入经N2稀释的SO2气体,发生反应H2SO3 + MnO2=MnSO4+H2O。下列措施中,目的是加快化学反应速率的是________(填字母代号)。

A. MnO2加入前先研磨 B.搅拌 C.提高混合气中N2比例
②已知实验室制取SO2的原理是Na2SO3 +2H2SO4(浓)=2NaHSO4+SO2↑+H2O。选择下图所示部分装置与上图装置相连制备MnSO4溶液,应选择的装置的接口顺序为_________(用箭头连接字母代号表示)。
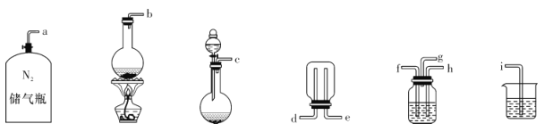
③若用空气代替N2进行实验,缺点是_______________。( 酸性环境下Mn2+不易被氧化)
(2)制备MnCO3固体:
实验步骤:
①向MnSO4溶液中边搅拌边加入饱和NH4HCO3溶液生成MnCO3沉淀,反应结束后过滤;
②...;.
③在70~80℃下烘干得到纯净干燥的MnCO3固体。
步骤②为__________,需要用到的试剂有_____________、_______、________。
II.设计实验方案
(3)利用沉淀转化的方法证明Ksp(MnCO3)<Ksp(NiCO3):__________________(已知NiCO3为难溶于水的浅绿色固体)。
(4)证明H2SO4的第二步电离不完全:_____________。[查阅资料表明K2(H2SO4)=1.1×10-2]
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,下列溶液中粒子的物质的量浓度关系正确的是
A.0.1mol/L NaHS溶液:c(H+)+c(Na+)=c(S2-)+c(HS-)+c(OH-)
B.0.1mol/L Na2CO3溶液:c(H2CO3)+c(HCO3-)+c(CO32-)=0.2 mol/L
C.浓度均为0.1 mol/L的 ① NH4Cl ②NH4Al(SO4)2 ③ NH4HCO3三种溶液,其中c(NH4+):②>①>③
D.pH=11的NaOH溶液与pH =3的CH3COOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均己充满电子。请回答下列问题:
(1) Z2+基态核外电子排布式为______________。
(2) YX4-的空间构型是______________,与YX4-互为等电子体的一种分子为_____________(填化学式);HYX4酸性比HYX2强,其原因是_____________。
(3)结构简式为RX (W2H3)2的化合物中R原子的杂化轨道类型为_____________;lmo1RX (W2H3) 2分子中含有σ键数目为_____________。
(4)往Z的硫酸盐溶液中通入过量的WH3,可生成[Z(WH3)4]SO4,下列说法正确的是_____________。
A. [Z(WH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)4]2+中Z2+给出孤对电子,NH3提供空轨道
C.在[Z(WH3)4]SO4组成元素中第一电离能最大的是氧元素
(5)某Y与Z形成的化合物的晶胞如图所示(黑点代表Z原子)。

①该晶体的化学式为_____________
②已知Z和Y的电负性分别为1.9和3.0,则Y与L形成的化合物属于_____________(填“离子”、“共价”)化合物。
③已知该晶体的密度为ρg.cm-3,阿伏加德罗常数为NA,则该晶体中Z原子和Y原子之间的最短距离为_____________pm(只写计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯吡格雷(Clopidogrel)是一种用于抑制血小板聚集的药物。以A为原料合成氯吡格雷的路线如下:
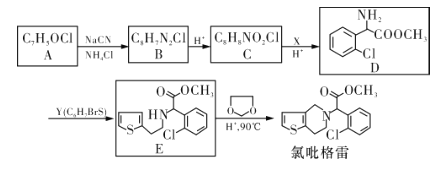
已知: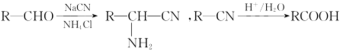 。
。
请回答下列问题:
(1)A中含氧官能团的名称为___________,C→D的反应类型是_____________。
(2)Y的结构简式为___________,在一定条件下Y与BrCl(一氯化溴,与卤素单质性质相似)按物质的量1:1发生加成反应,生成的产物可能有_______种。
(3)C分子间可在一定条件下反应生成含有3个六元环的产物,该反应的化学方程式为_________________________________。
(4)由E转化为氯吡格雷时,生成的另一种产物的结构简式为_______________。
(5)写出A的所有同分异构体(芳香族化合物)的结构简式:___________________(只有一个环、不考虑立体异构)。
(6)请结合题中信息写出以![]() 为有机原料制备化合物
为有机原料制备化合物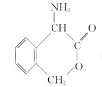 的合成路线流程图(无机试剂任选)。______________________________________________。合成流程图示例如下:
的合成路线流程图(无机试剂任选)。______________________________________________。合成流程图示例如下:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】I.亚硫酸钠的氧化反应:2Na2SO3 (aq) +O2(aq)=2Na2SO4(aq) H=x kJ/mol。其反应速率受溶解氧浓度影响,分为富氧区和贫氧区两个阶段。
(1)已知O2(g) ![]() O2(aq) H=y kJ/mol,Na2SO3 溶液与O2(g)反应的热化学方程式为___________________。
O2(aq) H=y kJ/mol,Na2SO3 溶液与O2(g)反应的热化学方程式为___________________。
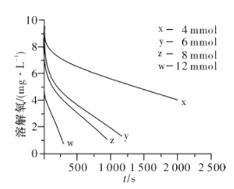
(2)291.5 K时,1.0 L溶液中Na2SO3初始量分别为4、6、8、12 mmol,溶解氧浓度初始值为9.60 mg/L,每5 s记录溶解氧浓度,实验结果如图所示。当Na2SO3初始量为12 mmol,经过20 s溶解氧浓度降为6.40 mg/L,则0~20s内Na2SO3的平均反应速率为_______mol/(L·s)。
(3)为确定贫氧区速率方程v=k·ca(SO32-)·cb(O2)中的a、b的值(取整数),分析实验数据。
c(Na2SO3)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
v×106 | 10.2 | 24.4 | 44.7 | 103.6 |
①当溶解氧浓度为4.0 mg/L时,c(SO32-)与速率数值关系如表(甲)所示,则a=____。
②当溶解氧浓度小于4.0mg/L时,图中曲线皆为直线,Na2SO3氧化速率与溶解氧浓度无关,则b=_______。
(4)两个阶段不同温度的速率常数之比如表(乙)所示。已知![]() ,R为常数。Ea(富氧区)_____ (填“>”或“<”)Ea(贫氧区)。
,R为常数。Ea(富氧区)_____ (填“>”或“<”)Ea(贫氧区)。
反应阶段 | 速率方程 |
|
富氧区 | v=k·c (SO32-)·c (O2) | 1.47 |
贫氧区 | v=k·ca (SO32-)·cb(O2) | 2.59 |
II. (5)在容积固定的密闭容器中,起始充入0.2 mol SO2和0.1 mol O2,反应体系起始总压强0.1MPa。反应在一定温度下达到平衡时SO2的转化率为90%。该反应的压强平衡常数Kp=________ ( 分压=总压×物质的量分数)(写单位)。
(6)利用原电池原理,也可用SO2和O2来制备硫酸,该电池用多孔材料作电极。请写出该电池负极反应式_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将NaCl和CuSO4两种溶液等体积混合后用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图所示,则下列说法正确的是
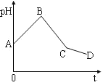
A.整个过程中两电极反应2Cl--2e-=Cl2↑、2H+2e-=H2↑不可能同时发生
B.电解至C点时,往电解质溶液中加入适量CuCl2固体,即可使电解质溶液恢复至原来的浓度
C.AB段表示电解过程中H+被还原,pH增大
D.原混合溶液中NaCl和CuSO4浓度之比恰好为2:1
查看答案和解析>>
科目: 来源: 题型:
【题目】图Ⅰ是NO2(g)+CO(g)CO2(g)+NO(g)应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示。

下列有关说法正确的是
A.一定条件下,向密闭容器中加入1 mol NO2(g)与1 mol CO(g)反应放出234kJ热量
B.若X表示温度,则Y表示的可能是CO2的物质的量浓度
C.若X表示CO的起始浓度,则Y表示的可能是NO2的转化率
D.若X表示反应时间,则Y表示的可能是混合气体的密度
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中![]() 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,水中存在电离平衡:H2OH++OH- △H>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体CH3COONa,平衡正向移动,c(H+)增大
D.将水加热,KW增大,pH减小,酸性增强
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA
B.常温下,1L pH=10的氨水溶液中,发生电离的水分子数为1×10-10NA
C.电解精炼铜时,阴极增重3.2g,电路中转移电子数为0.05NA
D.将0.1mol O2与0.2mol NO在密闭容器中充分反应,反应后容器内分子数为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com