
科目: 来源: 题型:
【题目】根据原电池的知识,下列反应可设计成原电池的是( )
A.CH3CH2OH+3O2![]() 2CO2+3H2O
2CO2+3H2O
B.Ba(OH)28H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
C.H2SO4+2NaOH=Na2SO4+2H2O
D.CaO+H2O=Ca(OH)2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.T℃时,pH=7的溶液一定呈中性
B.已知反应2NO2(g)![]() N2O4(g)在低温下可自发进行,则△H>0
N2O4(g)在低温下可自发进行,则△H>0
C.在0.1molL-1的NH4Cl溶液中:c(NH4+)+c(NH3H2O)=0.1molL-1
D.在Na2CO3溶液中:c(Na+)=2c(CO32-)
查看答案和解析>>
科目: 来源: 题型:
【题目】中华人民共和国国家标准(GB27602011)规定葡萄酒中SO2最大使用量为0.25g·L-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
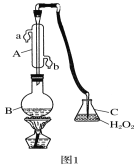
(1)仪器A的名称是_________,水通入A的进口为________。(a/b)
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为__________________。
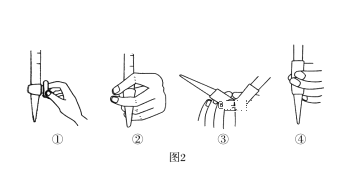
(3)除去C中过量的H2O2,然后用0.0900mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择题图2中的______ (填序号);若滴定终点时溶液的pH=8.8,则选择的指示剂为_________(酚酞/甲基橙);若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积____(填序号)(①=10mL,②=40mL,③<10mL,④>40mL)。
(4)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为_______g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的开关时,观察到电流表的指针发生了偏转。

请回答下列问题:
(1)甲池为_____(填“原电池”“电解池”或“电镀池”),通入CH3OH电极的电极反应式为_________________________。
(2)乙池中C(石墨)电极的名称为____(填“正极”“负极”或“阴极”“阳极”),总反应的化学方程式为_________________________。
(3)当乙池中D极质量增加5.4g时,甲池中理论上消耗O2的体积为_____mL(标准状况),转移的电子数为__________
(4)丙池中_____(填“E”或“F”)极析出铜。
(5)若丙中电极不变,将其溶液换成NaCl溶液,开关闭合一段时间后,丙中溶液的pH将_____(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)锂空气电池比传统的锂离子电池拥有更强的蓄电能力,是传统锂离子电池容量的10倍,其工作原理示意图如图。

放电时,b电极为电源的__极,电极反应式为__。
(2)汽车尾气中CO、NO2在一定条件下可发生反应4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g),一定温度下,向容积固定的2L的密闭容器中充入一定量的CO和NO2,NO2的物质的量随时间的变化曲线如图所示。
4CO2(g)+N2(g),一定温度下,向容积固定的2L的密闭容器中充入一定量的CO和NO2,NO2的物质的量随时间的变化曲线如图所示。

①0~10min内该反应的平均反应速率v(CO)=__。
②恒温恒容条件下,不能说明该反应已经达到平衡状态的是__(填序号)。
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C.容器内混合气体密度保持不变
查看答案和解析>>
科目: 来源: 题型:
【题目】298K时,将20mL3xmol·L-1Na3AsO3、20mL3xmol·L-1I2和20mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq)![]() AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
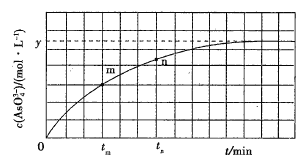
下列可判断反应达到平衡的是__(填标号)
a溶液的pH不再变化
b.v(I-)=2v(AsO33-)
c.![]() 不再变化
不再变化
d.c(I-)=ymol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是几种常见弱酸的电离平衡常数(25℃ )
化学式 | H2CO3 | CH3COOH | HClO |
电离平衡常数 | K1=4.3×10-7 K2=5.6×10-11 | 1.8×10-5 | 3.0×10-8 |
(1)根据分析表格中数据可知,H2CO3、CH3COOH、HClO三种酸的酸性从强到弱依次是_____________________________________。
(2)常温下,0.1molL﹣1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_________(填字母)
A.c(H+)B.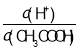 C.c(H+)c(OH﹣)D.
C.c(H+)c(OH﹣)D.![]() E.
E.![]()
(3)25℃时,等浓度的Na2CO3、CH3COONa和NaClO三种溶液的pH从小到大依次是_____________________________________。
(4)25℃时,将a molL﹣1的醋酸与b molL﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,溶液中离子浓度大小关系:_________________
(5)下列反应不能发生的是______(填字母)。
a.![]() +2CH3COOH=2CH3COO-+CO2↑+H2O b.ClO-+CH3COOH=CH3COO-+HClO
+2CH3COOH=2CH3COO-+CO2↑+H2O b.ClO-+CH3COOH=CH3COO-+HClO
c.![]() +2HClO=CO2↑+H2O+2ClO- d.2ClO-+CO2+H2O=
+2HClO=CO2↑+H2O+2ClO- d.2ClO-+CO2+H2O=![]() +2HClO
+2HClO
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,纳和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() Na2CO3+C。下列说法错误的是( )
Na2CO3+C。下列说法错误的是( )
A.放电时,ClO4-向负极移动
B.放电时,Na+向正极移动
C.放电时,正极反应为:3CO2+3e-=2CO32-+C
D.放电时,正极反应为:Na++e-=Na
查看答案和解析>>
科目: 来源: 题型:
【题目】一种可充电锂空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是( )
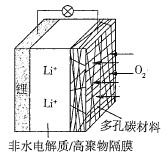
A.放电时,多孔碳材料电极为负极
B.放电时,外电路电子由多孔碳材料电极流向锂电极
C.放电时,电解质溶液中Li+向锂电极迁移
D.放电时,电池总反应为2Li+(1-![]() )O2=Li2O2-x
)O2=Li2O2-x
查看答案和解析>>
科目: 来源: 题型:
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,同温度下涉及如下反应:
① 2NO(g)+Cl2(g)![]() 2ClNO(g) ΔH1<0 平衡常数为K1;
2ClNO(g) ΔH1<0 平衡常数为K1;
② 2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) ΔH2<0 平衡常数为K2;
NaNO3(s)+ClNO(g) ΔH2<0 平衡常数为K2;
(1)4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) ΔH3,平衡常数K的表达式为:_________________。ΔH3=__________(用ΔH1、ΔH2表示)。
2NaNO3(s)+2NO(g)+Cl2(g) ΔH3,平衡常数K的表达式为:_________________。ΔH3=__________(用ΔH1、ΔH2表示)。
(2)①为研究不同条件对反应①的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应①达到平衡。测得10min内v(ClNO)=7.5×10-3mol·L-1·min-1,则平衡后n(Cl2)=______mol,NO的转化率α1=______。
②其他条件保持不变,反应②升高温度,平衡时NO2的转化率_____((填“增大”“减小”或“不变”),平衡常数K2______(填“增大”“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com