
科目: 来源: 题型:
【题目】中国政府网于 2020 年 2 月 17 日发布了关于磷酸氯喹对感染新冠状病毒患者疗效的说明。查阅“磷酸氯喹”合成的相关文献,得到磷酸氯喹中间体合成路线如下:
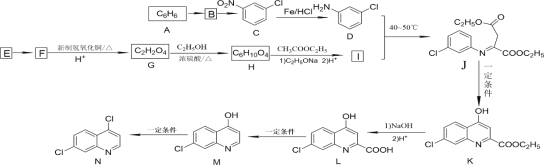
已知:①氯原子为苯环的邻对位定位基,它会使第二个取代基主要进入它的邻对位;硝基为苯环的间位定位基,它会使第二个取代基主要进入它的间位。
②E为汽车防冻液的主要成分。
③![]()
(1)写出 B 的名称_____,B→C 的反应试剂_____。
(2)C→D 的反应类型为_____,M→N 的反应类型为_____。
(3)写出 H生成 I的化学方程式_____。
(4)1mol J与氢氧化钠反应最多消耗_________mol NaOH,L与足量 H2 完全加成后的产物中手性碳原子的数目为_____(手性碳原子连接的四个基团都不同)。
(5)H有多种同分异构体,其满足下列条件的有_________种(不考虑手性异构),其中核磁共振氢谱峰面积比为 1:1:2:6 的结构简式为_____。
①只有两种含氧官能团 ②能发生银镜反应 ③1mol 该物质与足量的 Na 反应生成 0.5mol H2
(6)已知:
参照上述合成路线及信息,设计由硝基苯和![]() 为原料合成
为原料合成 的路线_____ (无机试剂任选)
的路线_____ (无机试剂任选)
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸亚铁(白色固体,难溶于水)是一种重要的工业原料,可用于制备补血剂乳酸亚铁,也可用作可充电电池的电极。某研究小组通过下列实验,寻找利用复分解反应制备FeCO3的最佳方案:
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
| 0.8 mol/L FeSO4溶液 (pH=4.5) | 1 mol/L Na2CO3溶液 (pH=11.9) | 实验Ⅰ:立即产生灰绿色沉淀,5min后出现明显的红褐色 |
0.8 mol/L FeSO4溶液 (pH=4.5) | 1 mol/L NaHCO3溶液 (pH=8.6) | 实验Ⅱ:产生白色沉淀及少量无色气泡,2min后出现明显的灰绿色 | |
0.8 mol/L (NH4)2Fe(SO4)2 溶液(pH=4.0) | 1 mol/L NaHCO3溶液 (pH=8.6) | 实验Ⅲ:产生白色沉淀及无色气泡,较长时间保持白色 | |
(1)实验I中红褐色沉淀产生的原因可用如下反应表示,请补全反应:_____________
![]() Fe2++
Fe2++ ![]() +
+ ![]() +
+ ![]() H2O
H2O ![]()
![]() Fe(OH)3 +
Fe(OH)3 + ![]() HCO3
HCO3
(2)实验II中产生FeCO3的离子方程式为__________________。
(3)为了探究实验III中NH4+所起的作用,甲同学设计了实验IV进行探究:
操作 | 现象 | |
实验IV | 向0.8 mol/L FeSO4溶液中加入________,再加入一定量Na2SO4固体配制成混合溶液(已知Na+对实验无影响,忽略混合后溶液体积变化)。再取该溶液一滴管,与2mL 1mol/L NaHCO3溶液混合 | 与实验III现象相同 |
实验IV中加入Na2SO4固体的目的是_________。
对比实验II、III、IV,甲同学得出结论:NH4+水解产生H+,降低溶液pH,减少了副产物Fe(OH)2的产生。
乙同学认为该实验方案不够严谨,应补充的对比实验操作是:_________,再取该溶液一滴管,与2mL 1mol/L NaHCO3溶液混合。
(4)小组同学进一步讨论认为,定性实验现象并不能直接证明实验III中FeCO3的纯度最高,需要利用如图所示的装置进行定量测定。分别将实验I、II、III中的沉淀进行过滤、洗涤、干燥后称量,然后转移至A处的广口瓶中。

① 补全A中装置并标明所用试剂。____________
② 为测定FeCO3的纯度,除样品总质量外,还需测定的物理量是____________。
(5)实验反思:经测定,实验III中的FeCO3纯度高于实验I和实验II。通过以上实验分析,制备FeCO3实验成功的关键因素是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以NOx 为主要成分的雾霾的综合治理是当前重要的研究课题。
I.汽车尾气中的 NO(g)和 CO(g)在一定条件下可发生反应生成无毒的N2 和 CO2:
(1)已知:①N2(g)+O2(g)![]() 2NO(g) △H1= +180.5 kJ·mol-1 ②CO 的燃烧热△H2 = - 283.0 kJ·mol-l,则反应③ 2NO(g)+2CO(g)
2NO(g) △H1= +180.5 kJ·mol-1 ②CO 的燃烧热△H2 = - 283.0 kJ·mol-l,则反应③ 2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H3 =_______。
N2(g)+2CO2(g) △H3 =_______。
(2)某研究小组在三个容积为 5 L 的恒容密闭容器中,分别充入 0.4mol NO 和 0.4 mol CO,发生反应③ 。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示:

①温度:T1_____T2(填“<”“=”或“>”)。
②CO 的平衡转化率:Ⅰ_____Ⅱ_____Ⅲ(填“<”“=”或“>”)。
③反应速率:a 点的 v逆_____b 点的 v正 (填“<”“=”或“>”)。
④T2 时的平衡常数 Kc=_____。
(3)将 NO和 CO以一定的流速通过两种不同的催化剂(cat1、cat2)进行反应,相同时间内测量的脱氮率(脱氮率即 NO的转化率)如图所示。M 点_____(填“是”或“不是”)对应温度下的平衡脱氮率, 说明理由_________。

Ⅱ.N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解反应 2N2O=2N2+O2对环境保护有重要意义。
(4)碘蒸气存在能大幅度提高 N2O 的分解速率,反应历程为:
第一步 I2(g)![]() 2I(g)快速平衡,平衡常数为K
2I(g)快速平衡,平衡常数为K
第二步 I(g)+N2O(g)→N2(g)+IO(g) v = k1·c(N2O)·c(I) 慢反应
第三步 IO(g)+N2O(g)→N2(g)+O2(g)+1/2I2(g) 快反应
其中可近似认为第二步反应不影响第一步的平衡。实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。
① k =_____(用含 K 和 k1 的代数式表示)。
②下列表述正确的是_____。
a.IO 为反应的中间产物
b.碘蒸气的浓度大小不会影响 N2O的分解速率
c.第二步对总反应速率起决定作用
d.催化剂会降低反应的活化能,从而影响△H
(5)通过 N2O 传感器可监测环境中 N2O 的含量,其工作原理如图所示

①NiO电极上的电极反应式为_____。
②N2O浓度越高,则电压表读数越_____。(填“高”或“低”)
查看答案和解析>>
科目: 来源: 题型:
【题目】测定有机化合物中碳和氢的组成常用燃烧分析法。如图是德国化学家李比希测定有机物组成的装置,氧化铜作催化剂,在750℃左右使有机物在氧气流中全部氧化为CO2和H2O,用含有固体氢氧化钠和氯化钙的吸收管分别吸收CO2和H2O。
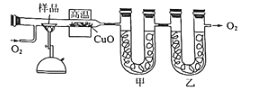
试回答下列问题:
(1)甲装置中盛放的药品是______。
(2)将4.6g 有机物A进行实验,测得生成5.4gH2O和8.8gCO2,则该物质中各元素的原子个数比是______。
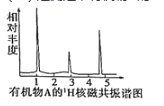
(3)经测定,有机物A的1H核磁共振谱如图,则A的结构简式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】储氢材料是一类能可逆地吸收和释放氢气的材料。LaNi5合金、NaBH4、H3B-NH3、Mg2NiH4等都是潜在储氢材料。回答下列问题:
(1)基态Ni原子的核外电子排布式为____,有___________个未成对的电子;
(2)NaBH4中H为-1价,Na、B、H电负性由大到小的顺序是_________。BH4-离子的立体构型为________,其中B的杂化轨道类型为_____。
(3)B2H6和NH3化合可以生成H3B-NH3,H3B-NH3加热时发生反应:H3B-NH3=BN+3H2,缓慢释放出H2。BN有类似于石墨的结构,B2H6、NH3和BN的沸点由高到低的顺序为_________, 原因是___。
(4)X-射线衍射分析表明,Mg2NiH4 的立方晶胞的面心和顶点均被Ni原子占据,所有Mg原子的Ni配位数都相等。则Mg原子填入由Ni原子形成的_____空隙中(填“四面体”或“八面体”),其空隙占有百分率为_____。
(5)已知Mg2NiH4 晶体的晶胞参数为646.5 pm,液氢的密度为0.0708 g·cm-3。若以材料中氢的密度与液态氢密度之比定义储氢材料的储氢能力,则Mg2NiH4 的储氢能力是液氢的___倍(列出计算式即可)。

查看答案和解析>>
科目: 来源: 题型:
【题目】H2CO3 和 H2C2O4 都是二元弱酸,常温下,不同 pH环境下它们不同形态的粒子的组成百分率如图所示:

下列说法正确的是( )
A.在 pH为6.37及10.25时,溶液均存在 c(H2CO3)=c(HCO3-)=c(CO32-)
B.反应 CO32-+H2O![]() HCO3-+OH- 的平衡常数为10-7.23
HCO3-+OH- 的平衡常数为10-7.23
C.0.1 mol·L-1NaHC2O4 溶液中 c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D.往Na2CO3溶液中加入少量草酸溶液,发生反应:2CO32+H2C2O4=2HCO3+C2O42
查看答案和解析>>
科目: 来源: 题型:
【题目】治理SO2、CO、NOx污染是化学工作者研究的重要课题。
Ⅰ.硫酸厂大量排放含SO2的尾气会对环境造成严重危害。
(1)工业上可利用废碱液(主要成分为Na2CO3)处理硫酸厂尾气中的SO2,得到Na2SO3溶液,该反应的离子方程式为______。
Ⅱ.沥青混凝土可作为反应;2CO(g)+O2(g)2CO2(g)的催化剂。如图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
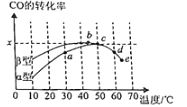
(2)a、b、c、d四点中,达到平衡状态的是______。
(3)已知c点时容器中O2浓度为0.02molL-1,则50℃时,在α型沥青混凝土中CO转化反应的平衡常数K=______(用含x的代数式表示)。
(4)观察分析图,回答下列问题:

①CO转化反应的平衡常数K(a)______K(c)。
②在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率比α型要______(填“大”、“小”)。
③______点时CO与O2分子之间发生有效碰撞的几率在整个实验过程中最高。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮元素能够形成多种化合物。请回答下列问题:
(1)连氨(N2H4)常温下为液态,在空气中迅速完成燃烧生成N2,同时放出大量热,可作导弹、宇航飞船、火箭的燃料。
已知:H2(g)+![]() O2(g)═H2O(l)△H1=-285.8kJmol-1
O2(g)═H2O(l)△H1=-285.8kJmol-1
N2(g)+2H2(g)═N2H4(l)△H2=+50.6kJmol-1
则N2H4(l)在空气燃烧生成液态水的热化学方程式为______。
(2)工业上利用氨气生产氢氰酸(HCN)的反应CH4(g)+NH3(g)HCN(g)+3H2(g)△H>0。一定温度下,向2L恒容容器中充入1molCH4(g)和2molNH3(g)发生上述反应,4min达到平衡时,测得CH4的转化率为![]() 。0-4min内,用H2表示的该反应速率v(H2)=______。
。0-4min内,用H2表示的该反应速率v(H2)=______。
保持温度和容积不变,再向平衡后的容器中充入2molNH3和2molH2,此时v正______v逆(选填“>”“<”或“=”)。
(3)NH3能够形成Ag(NH3)2+。
①溶液中存在Ag+(aq)+2NH3(aq)Ag(NH3)2+(aq),其平衡常数的表达式为K稳=______。
②常温下,K稳[Ag(NH3)2+]=1.10×107,反应AgCl(s)+2NH3(aq)Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=1.936×10-3,则Ksp(AgCl)=______。
(4)硫氧化物和氮氧化物是常见的大气污染物,利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。
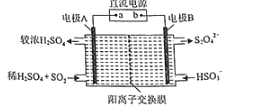
①电极A的电极反应式为______。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应离子方程式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增。已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的1/2,F是同周期元素中原子半径最小的元素;D2﹣与E2+的电子层结构相同。B与D可以形成三原子化合物甲。A是非金属元素,且A、C、F可形成离子化合物乙。请回答:
(1)C单质的电子式_____,F元素原子的电子排布式_____,E元素的原子结构示意图是_____;
(2)化合物乙中含有的化学键是_____;
(3)化合物甲的结构式_____,固体时属于_____晶体。
查看答案和解析>>
科目: 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:

结合实验,下列说法不正确的是( )
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com