
科目: 来源: 题型:
【题目】下列叙述正确的是
A.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中 增大
增大
B.在0.1 mol/LCH3COONa溶液中:c(OH﹣)+0.1mol/L>c(CH3COOH)+c(H+)+c(Na+)
C.在10mL 0.1 mol/L的AgNO3溶液中加入6mL等浓度的NaCl溶液,有白色沉淀产生,再加入6 mL等浓度的Na2S溶液,溶液中又有黑色沉淀生成,说明Ksp(Ag2S)< Ksp(AgCl)
D.常温下,10 mL 0.02 mol/L HCl溶液与10 mL 0.02 mol/LBa(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2是一种优良的消毒剂,熔点为-59.5℃,沸点为11.0℃,浓度过高时易发生分解引起爆炸,实验室在50℃时制备ClO2。
实验Ⅰ:制取并收集ClO2,装置如图所示:
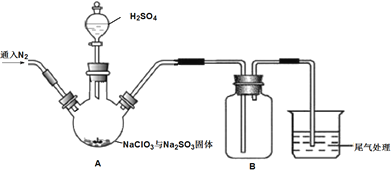
(1)写出用上述装置制取ClO2的化学反应方程式_____________。
(2)装置A中持续通入N2的目的是___________。装置B应添加__________(填“冰水浴”、“沸水浴”或“50℃的热水浴”)装置。
实验Ⅱ:测定装置A中ClO2的质量,设计装置如图:
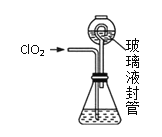
过程如下:
①在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;
②按照右图组装好仪器;在玻璃液封管中加入①中溶液,浸没导管口;
③将生成的ClO2由导管通入锥形瓶的溶液中,充分吸收后,把玻璃液封管中的水封溶液倒入锥形瓶中,洗涤玻璃液封管2—3次,都倒入锥形瓶,再向锥形瓶中加入几滴淀粉溶液;
④用c mol·L1 Na2S2O3标准液滴定锥形瓶中的液体,共用去V mL Na2S2O3溶液(已知:I2+2S2O32-=2I+S4O62-)。
(3)装置中玻璃液封管的作用是_____________。
(4)滴定终点的现象是___________________。
(5)测得通入ClO2的质量m(ClO2)=_______g(用整理过的含c、V的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学研究小组探究外界条件对化学反应速率和化学平衡、溶液pH影响的图像,其中图像和实验结论表达均正确的是

A.①是其他条件一定时,反应速率随温度变化的图像,正反应△H<0
B.②是在平衡体系的溶液中加入少量KCl晶体后化学反应速率随时间变化的图像
C.③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线
D.④是表示Cl2通入H2S溶液中pH变化
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,将3molA和1molB两种气体混合于固定容积2L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g)。经2min该反应达到平衡状态,生成0.8molD,测得C的浓度为0.8mol/L。则下列判断错误的是
A.x=4
B.2min内B的反应速率为0.1mol·L-1·min-1
C.B的转化率为40%
D.该温度下平衡常数的值为1.2
查看答案和解析>>
科目: 来源: 题型:
【题目】辉铜矿(主要成分Cu2S)作为铜矿中铜含量最高的矿物之一,可用来提炼铜和制备含铜化合物。
Ⅰ.湿法炼铜用Fe2(SO4)3溶液作为浸取剂提取Cu2+:
(1)反应过程中有黄色固体生成,写出反应的离子方程式______________________。
(2)控制温度为85℃、浸取剂的pH = 1,取相同质量的辉铜矿粉末分别进行如下实验:
实验 | 试剂及操作 | 3小时后Cu2+浸出率(%) |
一 | 加入10mL 0.25mol·L-1Fe2(SO4)3溶液和5 mL水 | 81.90 |
二 | 加入10 mL0.25mol·L-1Fe2(SO4)3溶液和5mL 0.1mol·L-1H2O2 | 92.50 |
回答:H2O2使Cu2+浸出率提高的原因可能是__________。
(3)实验二在85℃后,随温度升高,测得3小时后Cu2+浸出率随温度变化的曲线如图。Cu2+浸出率下降的原因_________________。
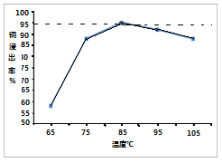
(4)上述湿法炼铜在将铜浸出的同时,也会将铁杂质带进溶液,向浸出液中通入过量的O2并加入适量的CuO,有利于铁杂质的除去,用离子方程式表示O2的作用_________。解释加入CuO的原因是_____。
Ⅱ.某课题组利用碳氨液((NH4)2CO3、NH3·H2O)从辉铜矿中直接浸取铜。
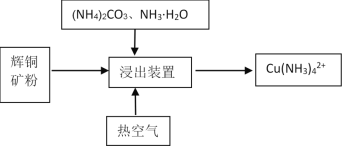
其反应机理如下:
①Cu2S(s)2Cu+(aq) +S2-(aq) (快反应)
②4Cu++O2+2H2O4Cu2++4OH- (慢反应)
③Cu2++4NH3·H2OCu(NH3)42++4H2O(快反应)
(5)提高铜的浸出率的关键因素是 ________。
(6)在浸出装置中再加入适量的(NH4)2S2O8,铜的浸出率有明显升高,结合平衡移动原理说明可能的原因是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.燃烧热的数值都会随反应物的用量不同而改变,故1mol S(s)和2mol S(s)的燃烧热不相等
B.已知:2C(s)+2O2(g)=2CO2(g)ΔH=akJ/mol;2C(s)+2O2(g)=2CO(g)ΔH=bkJ/mol 则a>b
C.H2(g)的燃烧热为285.8kJ/mol,则表示H2燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ/mol
D.反应NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) ΔH=+185.57kJ/mol,在低温条件下不能自发进行,但在高温条件下能自发进行
查看答案和解析>>
科目: 来源: 题型:
【题目】根据某有机物的结构:
(1)测定实验式:某含碳、氢、氧三种元素的有机物,经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%,则其实验式是________。
(2)确定分子式:下图是该有机物的质谱图,则其相对分子质量为______,分子式为________。
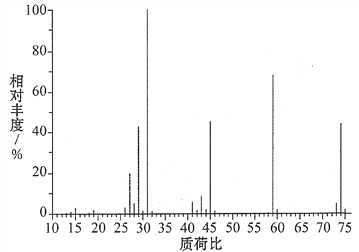
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气作为清洁能源有着广泛的应用前景,采用天然气制备氢气的流程如下。
![]()
请回答下列问题:
Ⅰ.蒸汽转化:在催化剂的作用下,水蒸气将CH4氧化,结合图表信息回答问题。
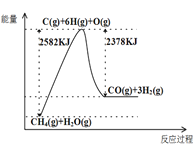
(1)该过程的热化学方程式是__________。
(2)平衡混合物中CO的体积分数与压强的关系如图所示,判断T1和T2的大小关系:T1_______T2(填“>”“<”或“=”),并说明理由__________。

(3)一定温度下,在1L恒容的密闭容器中充入1mol CH4和1mol水蒸气充分反应达平衡后,测得反应前后容器中气体的物质的量之比是3:4,计算该条件下反应的平衡常数为______________。
Ⅱ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
Ⅲ.模拟H2提纯工艺:将CO2和H2分离得到H2的过程如下:
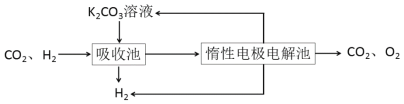
依据图示信息回答:
(4)吸收池中发生反应的离子方程式是_________。
(5)写出电解池中阳极发生的电极反应式________;结合化学用语说明K2CO3溶液再生的原因_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)有机物A(![]() )与
)与![]() 溶液反应显出颜色且苯环上有两个取代基的同分异构体有___种,试分别写出其结构简式:___。
溶液反应显出颜色且苯环上有两个取代基的同分异构体有___种,试分别写出其结构简式:___。
(2)M的化学式为C4H9Cl,已知A的核磁共振氢谱表明其只有一种氢原子,则M的化学名称为___。
(3)写出同时满足下列条件的分子式为C6H10O4的所有结构简式:___。
①只含一种官能团②链状结构且无—O—O—③核磁共振氢谱只有2组峰
(4)某化合物B是 的同分异构体,且分子中只有两种不同化学环境的氢原子。写出该化合物的结构简式:___(任写一种)。
的同分异构体,且分子中只有两种不同化学环境的氢原子。写出该化合物的结构简式:___(任写一种)。
查看答案和解析>>
科目: 来源: 题型:
【题目】探究Na2O2与水的反应,实验如图:
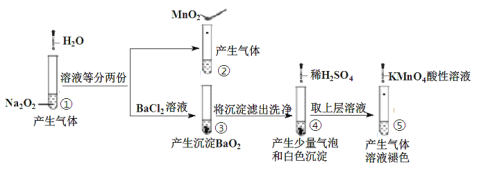
已知:H2O2H++HO2-;HO2-H++O22-
下列分析不正确的是
A.①、④实验中均发生了氧化还原反应和复分解反应
B.①、⑤中产生的气体能使带火星的木条复燃,说明存在H2O2
C.③和④不能说明溶解性:BaO2>BaSO4
D.⑤中说明H2O2具有还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com