
科目: 来源: 题型:
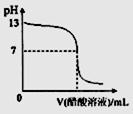 常温下,向10mL 0.1 mol·L-1NaOH溶液中逐滴加入0.1 mol·L-1醋酸溶液,所得滴定曲线如下图所示。下列说法正确的是 ( )
常温下,向10mL 0.1 mol·L-1NaOH溶液中逐滴加入0.1 mol·L-1醋酸溶液,所得滴定曲线如下图所示。下列说法正确的是 ( )
A.pH=7时,所加醋酸溶液的体积为10mL
B.pH<7时,溶液中:c(CH3COO-)>c(Na+)
C.7<pH<13时,溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.继续滴加0.1 mol·L-1醋酸溶液,溶液pH可以变为1
查看答案和解析>>
科目: 来源: 题型:
下列化学原理表述正确的是 ( )
A.氢硫酸溶液加水稀释,电离程度增大,H+浓度增大
B.Na2CO3溶液中满足:c(Na+)=2c(CO32-)+2 c(HCO3-)+ 2c(H2CO3)
C.NaHCO3溶液不显中性的原因:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
D.同体积同pH的盐酸和醋酸,与足量的锌反应,盐酸的反应速率快,生成H2的物质的量多
查看答案和解析>>
科目: 来源: 题型:
J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右下表。已知:J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素。下列说法错误的是 ( )
A.J和氢组成的化合物分子中只含有极性共价键
B.工业上用电解熔融的M的氧化物方法来制备M
C.R、T两元素的气态氢化物中,T的气态氢化物更稳定
D.J、M、R、T元素最高价氧化物对应的水化物中酸性最强的是HTO4
查看答案和解析>>
科目: 来源: 题型:
用NA表示阿伏加德罗常数。下列说法中,正确的是 ( )
A.1.8g重水(D2O)中含有的质子数为1.0 NA
B.500℃、30MPa下:N2(g)+3H2(g)![]() 2NH3(g);△H=-38.6kJ·mol-1;将1.5NA的H2和过量N2在此条件下充分反应,放出热量19.3kJ
2NH3(g);△H=-38.6kJ·mol-1;将1.5NA的H2和过量N2在此条件下充分反应,放出热量19.3kJ
C.标准状况下,11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA
D.60 g石英晶体中含有的Si-O键数目为2NA
查看答案和解析>>
科目: 来源: 题型:
下列叙述不正确的是 ( )
A.漂白粉的有效成分是Ca(ClO)2 B.胆矾的成分是CuSO4·5H2O
C.医疗上用的“钡餐”成分是BaSO4 D.光导纤维主要成分是Si
查看答案和解析>>
科目: 来源: 题型:
已知水在25℃和95℃时,其电离平衡曲线如右图所示:
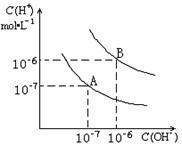 (1)25
(1)25 ![]() 时水的电离平衡曲线应为哪一条?
时水的电离平衡曲线应为哪一条?
(2)25![]() 时,将
时,将![]() =9的NaOH溶液与
=9的NaOH溶液与![]() =4的
=4的
![]() 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的 ![]() =7,则
=7,则
NaOH溶液与![]() 溶液的体积比为为多少?
溶液的体积比为为多少?
(3)95![]() 时,若100体积
时,若100体积![]() 1=
1=![]() 的某强酸溶液与1体积
的某强酸溶液与1体积![]() 2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的
2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的![]() 1与强碱的
1与强碱的![]() 2之间应满足的关系是?
2之间应满足的关系是?
查看答案和解析>>
科目: 来源: 题型:
氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程
示意图如下所示,完成下列填空:
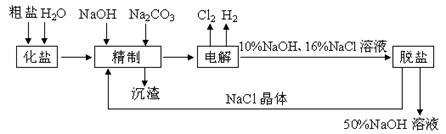
(1)在电解过程中,与电源正极相连的电极上电极反应为____________
______________,与电源负极相连的电极附近,溶液pH_________
(选填“不变”、“升高”或“下降”)。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为
____________________________________________________________。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试
剂可以是_________。
a. Ba(OH)2 b. Ba(NO3)2 c. BaCl2
(4)为了有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为_________
(选填a、b、c)
a. 先加NaOH,后加Na2CO3,再加钡试剂
b. 先加NaOH,后加钡试剂,再加Na2CO3
c. 先加Na2CO3,后加NaOH,再加钡试剂
查看答案和解析>>
科目: 来源: 题型:
(1)实事证明,能设计成原电池的反应通常是放热反应,
下列化学反应在理论上可以设计成原电池的是 。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)=2H2O(1) △H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,
其负极反应为:
查看答案和解析>>
科目: 来源: 题型:
现有电解质溶液:①Na2CO3 ②NaHCO3 ③CH3COONa ④ NaOH
(1)当四种溶液的pH相同时,其物质的量浓度由大到小的顺序是
(填编号,以下相同)
(2)在上述四种电解质溶液中,分别加入AlCl3溶液,无气体产生的是
查看答案和解析>>
科目: 来源: 题型:
用已知浓度的盐酸滴定未知浓度的氢氧化钾溶液,滴定过程中进行如下操作,分别 指出各项的操作对测定结果的影响(可用“偏高”、“偏低”、“无影响”).
(1)滴定前,滴定管尖咀处有气泡,滴定后气泡消失. .
(2)滴定管经蒸馏水洗涤后,即装入标准溶液进行滴定. .
(3)滴定前,锥形瓶用蒸馏水洗涤后,未用待测的氢氧化钾溶液润洗就做滴定. .
(4)用滴定管量取待测液后,又用蒸馏水洗涤滴定管,并将洗涤液一起注入锥形瓶中.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com