
科目: 来源: 题型:
下面的排序不正确的是( )
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4
B.熔点由高到低:Na>Mg>Al
C.硬度由大到小:金刚石>碳化硅>晶体硅
D.晶格能由大到小: NaF> NaCl> NaBr>NaI
查看答案和解析>>
科目: 来源: 题型:
下列四种元素中,其单质的氧化性最强的是( )
A.基态原子含有未成对电子最多的第二周期元素
B.位于元素周期表中第三周期第ⅢA族的元素
C.基态原子最外层电子排布为2s22p6的元素
D.基态原子最外层电子排布为3s23p5的元素
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是 ( )
A.HF、HCl、HBr、HI的熔点沸点依次升高
B.H2O的熔点、沸点大于H2S的是由于H2O分子之间存在氢键
C.乙醇分子与水分子之间只存在范德华力
D.氯的各种含氧酸的酸性由强到弱排列为
HClO>HClO2>HClO3>HClO4
查看答案和解析>>
科目: 来源: 题型:
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3; ③1s22s22p5。则下列有关比较中正确的是( )
A.第一电离能:③>②>① B.原子半径:③>②>①
C.电负性:③>②>① D.最高正化合价:③>②>①
查看答案和解析>>
科目: 来源: 题型:
氯化硼的熔点为-107℃,沸点为12.5℃,其分子中键与键之间的夹角为120o,它能水解,有关叙述正确的是( )
A.氯化硼熔融态时能导电 B.硼原子以sp杂化
C.氯化硼遇水蒸气会产生白雾 D.氯化硼分子呈三角锥形
查看答案和解析>>
科目: 来源: 题型:
已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的是( )
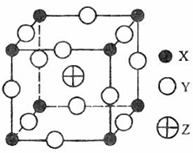
A.ZXY3 B.ZX2Y6
C.ZX4Y8 D.ZX8Y12
查看答案和解析>>
科目: 来源: 题型:
在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状
结构。则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是( )
A.sp,范德华力 B.sp2,范德华力
C.sp2,氢键 D.sp3,氢键
查看答案和解析>>
科目: 来源: 题型:
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为( )
A.两种分子的中心原子杂化类型不同,NH3为sp2型杂化,而CH4是sp3型杂化
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。
C.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强。
D.氨气分子是极性分子而甲烷是非极性分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com