
科目: 来源: 题型:
日本核电站附近检测到放射性原子131I。关于131I 原子和127I原子的叙述错误的是
A.它们互称为同位素 B.它们的化学性质几乎完全相同
C.它们相差4个质子 D.它们的电子数相同
查看答案和解析>>
科目: 来源: 题型:
钾是活泼的碱金属,钾和氧有氧化钾(K2O)、过氧化钾(K2O2)和超氧化钾(KO2)等多种化合物。
⑴钾和硝酸钾反应可制得氧化钾:K+KNO3→K2O+N2(未配平),每生成9.4gK2O消耗的还原剂有___________g
⑵超氧化钾和过氧化钾都能与二氧化碳反应均生成氧气和K2CO3,在医院、矿井、潜水、高空飞行中用作供氧剂。写出超氧化钾与二氧化碳反应的化学方程式
__________________________________________________________________________,为了维持气压稳定,可以使用超氧化钾和过氧化钾的混合物使吸收的CO2与生成的O2体积相同(同温同压),则它们的物质的量之比为n(KO2) : n(K2O2)=____________
⑶KO2加热至600℃部分分解得到产物A。6.30g产物A充分吸收二氧化碳生成碳酸钾并产生氧气1.12L(标准状况),试确定产物A中钾氧两种原子个数之比。如果产物A只含有两种化合物,写出所有可能的化学式并计算A中两种化合物的物质的量之比。
查看答案和解析>>
科目: 来源: 题型:
Cu、Cu2O和CuO组成的混合物,加入100mL0.6 mol·L-1HNO3溶液恰好使混合物完全溶解,完全生成硝酸铜、一氧化氮和水。现共收集到224mLNO气体(标准状况)。求:
1) 相同物质的量的Cu、Cu2O和CuO,消耗该浓度硝酸最多的是哪一种物质,写出其与该硝酸反应的离子方程式。
2) 如原混合物中含单质铜0.01moL,则其中Cu2O、CuO的物质的量分别为多少?
3) 求混合物中CuO的物质的量可能接近的最大值。
查看答案和解析>>
科目: 来源: 题型:
下图中D经氧化可以得到C,烃G分子中有2个甲基。
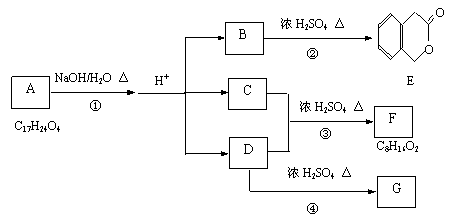 |
根据上图回答下列问题:
(1)B的分子式是_________________。③的反应类型是 。
(2)F的结构简式 ,反应①的化学方程式是(有机物须用结构简式表示):
。
(3)试写出3种C的同分异构体,要求代表除自身类别外3种不同类别的有机物。
查看答案和解析>>
科目: 来源: 题型:
等质量的甲、乙、丙、丁、戊、己6种只含C、H、O三种元素的有机物,分别充分燃烧时,消耗等量的O2,且生成的气体全部分别通过足量的浓硫酸、碱石灰后,浓硫酸与碱石灰质量增重之比均为9∶22。已知:
① 6 M(甲)=3 M(乙)=3 M(丙)=3 M(丁)=2 M(戊)=M(己)=180;
② 乙、戊的水溶液可使甲基橙试液变红,相互之间在一定条件下能发生酯化反应;
③ 戊的核磁共振氢谱显示有4种不同特征的氢原子,数量之比为3∶1∶1∶1;
④ 甲、丙、丁、己均能发生银镜反应。丙不易溶于水但丁易溶于水。
请回答下列问题:
(1)甲的结构简式为 ;己有多种同分异构体,其中一种存在于糖尿病患者的尿液中,写出其结构简式 。
(2)乙、丙、丁三者之间的关系是 ;丁的结构简式为 。
(3)写出2分子戊生成1分子环状酯的化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 MgO、CaO等,生产工艺流程示意如下:
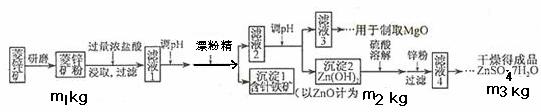
(1)将菱锌矿研磨成粉的目的是____ _,滤液1后两步操作的目是: 。
(2)完成加漂粉精反应的离子方程式:
□Fe(OH)2+□____+□_____ →□Fe(OH)3+□Cl-
(3)针铁矿的组成元素是Fe、O和H,化学式量为89,化学式是_______。
(4)为了了解如何调节滤液2的PH,请写出两个你认为需要查阅的数据
, (用文字叙述)
(5) “滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(6)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________。
查看答案和解析>>
科目: 来源: 题型:
某化学兴趣小组的同学用下图所示实验装置进行实验研究(图中a、b、c表示止水夹).请对其方案进行完善或评价;
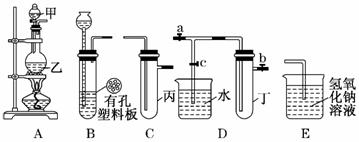 (1)实验室将B、C、E相连后,以 、 、
(1)实验室将B、C、E相连后,以 、 、
(填写名称)为原料可制取Cl2,为接下来研究氯气的化学性质做准备。
(2) 利用实验室常用方法制取氯气,将A、C、E相连,在丙中加入适量水,即可制得氯水.将所得氯水分为两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象、结论如下:
实验 序号 | 实验操作 | 现象 | 结论 |
Ⅰ | 将氯水滴入品红溶液 | 品红溶液褪色 | 氯气与水反应的产物有漂白性 |
Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气 泡产生 | 氯气与水反应的产物具有酸性 |
请你评价:实验Ⅰ后,推出相应结论是否合理? ________________。若不合理,请说明理由(若合理,则无需填写下行):
________________________________________________________________________.
实验Ⅱ推出相应的结论是否合理? ________________若不合理,请说明理由(若合理,无需填写下行):
________________________________________________________________________.
(3)A、C、E相连,可设计一个简单的实验,以验证Cl-和Br-的还原性强弱。有关反应的离子方程式为:____________________________________,
(4)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得并进行NO2有关实验.
①B中发生反应的化学方程式为______________________________________
②欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹________,再打开止水夹________,使烧杯中的水进入试管丁的可能的操作是_______________ _ 。
查看答案和解析>>
科目: 来源: 题型:
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知: §SO2(g) +1/2O2(g)![]() SO3(g)+ 98 kJ
SO3(g)+ 98 kJ
(1)某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正)
v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为20 L的密闭容器中充入0.4 mol SO2和0.2 mol O2,达到平衡后体积变为16 L,则平衡后SO2转化的百分率为 。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是 (填字母)。
A.保持温度和容器体积不变,充入0.2 mol O2
B.保持温度和容器内压强不变,充入0.4 mol SO3
C.降低温度
D.移动活塞压缩气体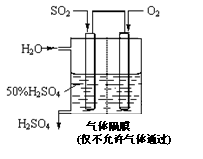
(4)若以右图所示装置,用电化学原理生产硫酸, 为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com