
科目: 来源: 题型:
右图装置的水溶液中存在如下平衡:AsO33-+H2O+I2![]() AsO43-+2H++2I-,当往上层溶液中
AsO43-+2H++2I-,当往上层溶液中
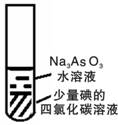 滴入足量试剂X并充分振荡,静置后下层液体变无色。则X可能是
滴入足量试剂X并充分振荡,静置后下层液体变无色。则X可能是
A. 双氧水 B. 蒸馏水 C. 碳酸氢钠溶液 D. 盐酸溶液
查看答案和解析>>
科目: 来源: 题型:
向浓盐酸中加入浓H2SO4时,会有白雾生成,不属于产生该现象的原因是
A.浓盐酸具有还原性 B.浓盐酸具有挥发性
C.浓H2SO4具有吸水性 D.气体溶质的溶解度随温度升高而降低
查看答案和解析>>
科目: 来源: 题型:
已知在25oC,101kPa下,1g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是
A.C8H18(l)+![]() O2(g)= 8CO2(g)+9H2O(g);ΔH = -48.40kJ/mol
O2(g)= 8CO2(g)+9H2O(g);ΔH = -48.40kJ/mol
B.C8H18(l)+![]() O2(g)= 8CO2(g)+9H2O(l);ΔH = -5518kJ/mol
O2(g)= 8CO2(g)+9H2O(l);ΔH = -5518kJ/mol
C.C8H18(l)+![]() O2(g)= 8CO2(g)+9H2O(l);ΔH = +5518kJ/mol
O2(g)= 8CO2(g)+9H2O(l);ΔH = +5518kJ/mol
D.C8H18(l)+![]() O2(g)= 8CO2(g)+9H2O(l);ΔH = -48.40kJ/mol
O2(g)= 8CO2(g)+9H2O(l);ΔH = -48.40kJ/mol
查看答案和解析>>
科目: 来源: 题型:
科学家预测:人类将在21世纪大量使用氢气作燃料。其中最理想获得氢气的途径是
A.以焦炭和水制取水煤气后分离出氢气
B.用铁、锌等活泼金属与稀硫酸反应制取氢气
C.由火力发电厂提供电力电解水产生氢气
D.利用高效催化剂和太阳能使海水分解产生氢气
查看答案和解析>>
科目: 来源: 题型:
有一化学样品Na2SO3,可能含有NaCl、Na2SO4、KNO3、K2CO2、K2SO4中的一种或几种杂质,某实验小组利用图12提供的装置确定该样品的成分及Na2SO3的质量分数。称此样品6.30g,加入6.0mol·L-1的硫酸至过量,产生无色气体560mL(标准状况),向逸出气体后的溶液中加入稍过量的BaCl2溶液,得到白色沉淀9.32g,透过蓝色钻玻璃观察,滤液的焰色反应无紫色。请回答下列问题:
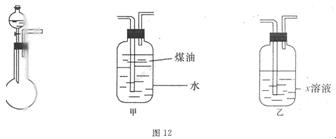
(1)溶液X是 ,煤油的作用是 。
(2)若实验中加入硫酸溶液的体积为5.00mL,则样品中Na2SO3的质量分数是 ,
写出有关离子方程式 。
(3)结合已提供的实验仪器,设计实验(实验仪器自选)如何正确测出气体的体积,简述操作步骤:
。
(4)说明一定含有硫酸钠的依据:
。
查看答案和解析>>
科目: 来源: 题型:
下图为中学化学中几种常见物质的转化关系(部分产物已略去)。已知:A、C、D是常见的气体单质,F气体极易溶于水,且液态常做制冷剂。
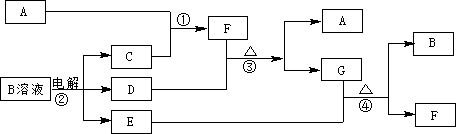
(1)写出化学式A ,D ,F ,G属于 晶体;
(2)鉴定G中阳离子的实验方法和现象_____________________________;
(3)D单质和E溶液反应,生成一种常见的消毒剂和漂白剂的有效成分,写出D+E溶液反应的离子方程式和③的化学方程式 、
。
(4)常温下,电解B溶液制得pH = 12的烧碱溶液1000mL则反应中转移的电子数目为 。
查看答案和解析>>
科目: 来源: 题型:
关于如图所示的装置的叙述,正确的是:
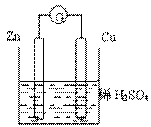
A.电流从锌片经导线流向铜片
B.一段时间后,电解质溶液中的硫酸根浓度减少
C.铜是正极,铜片上有气泡产生,锌片质量减少
D.一段时间后,电解质溶液的酸碱性保持不变
查看答案和解析>>
科目: 来源: 题型:
MnO2和锌是制造干电池的主要原料。某地有软锰矿和闪锌矿两座矿山,它们的主要成份为:
软锰矿:MnO2含量≥65% Al2O3含量为4%
闪锌矿:ZnS含量≥80% FeS、 CuS、 CdS含量各为2%
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液经净化后再进行电解,MnO2在电解池的阳极析出。
电解锌的传统生产工艺为:闪锌矿高温氧化脱硫再用热还原法还原得粗锌:
2ZnS+O2![]() 2ZnO+2SO2 2C+O2
2ZnO+2SO2 2C+O2![]() 2CO ZnO+CO
2CO ZnO+CO![]() Zn(g)+CO2
Zn(g)+CO2
将用热还原法制得的粗锌溶于硫酸,再电解ZnSO4溶液可生产纯度为99.95%的锌。
现在生产MnO2和锌的新工艺主要是通过电解获得MnO2和锌,副产品是硫、金属铜和镉。简化流程杠图如下:
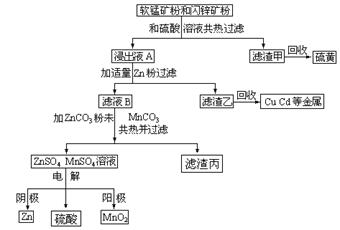
试回答下列问题:
(1)Zn的原子序数为30,它在元素周期表中的位置是 ;软锰矿、闪锌矿粉未与硫酸溶液共热时析出硫的反应为氧化-还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,据此写出MnO2在酸性溶液中分别FeS发生氧化-还原反应的化学方程式 ;软锰矿中Al2O3溶于硫酸的离子方程式 ;由滤渣甲回收硫黄的实验方法是 ;
(2)用离子方程式表示浸出液A与适量Zn粉作用得到滤液B与滤渣乙的过程 ______________________________________________________________________。
(3)滤渣丙的化学成分是 ;
(4)用铁和铂电极电解MnSO4和ZnSO4的混合溶液可以得到Zn和MnO2,电解时,铁做 极,铁极发生的电极反应为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com