Tesoon.com 天星版权 D. c(Na+)+c(H+)=c(S2ˉ)+c(HSˉ)+c(OHˉ)
试题详情
16.某酸性溶液中只有Na+、CH3COOˉ、H+、OHˉ四种离子。则下列描述正确的是 A.该溶液可能由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成 B.该溶液可能由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 C. 加入适量的NaOH,溶液中离子浓度关系一定为 c(CH3COOˉ)> c(Na+)> c(0Hˉ)> c(H+) D. 加入适量氨水,c(CH3COOˉ)一定大于c(Na+)、c(NH4+)之和 第II卷 非选择题(共60分) 试题详情
17.(6分)25℃时,水的离子积为 ;100℃时,水的离子积为 ;100℃时,水的离子积为 。若在100℃,将pH=11的 NaOH溶液aL与pH=l的H2SO42溶液bL混合,请填空: 。若在100℃,将pH=11的 NaOH溶液aL与pH=l的H2SO42溶液bL混合,请填空: (1) 100℃比25℃时水的离子积较大的原因是
。 (2)若所得溶液为中性,则a:b= ;若所得混合溶液的pH=2,则a:b= 。 试题详情
18.(12分)某种胃药片的制酸剂为碳酸钙,其中所含的制酸剂质量的测定如下: 试题详情
①需配制0.1mol?Lˉ1,的盐酸和0.1mol?Lˉ1的氢氧化钠溶液; 试题详情
②取一粒(药片质量均相同)0.2g的此胃药片,磨碎后加入20.00mL蒸馏水; 试题详情
③以酚25.00mL0.1mol?Lˉ1的盐酸溶液。 (1)写出实验过程的步骤(写编号顺序)
试题详情
(2)下图所示的仪器中配制0.1mol?Lˉ1盐酸溶液和0.1mol?Lˉ1氢氧化钠溶液肯定不需要的仪器是(填序号) 配制上述溶液还需要的玻璃仪器是(填仪器名称) 。 试题详情
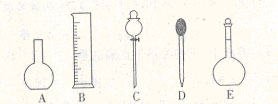
(3)配置上述溶液应选用的容量瓶的规格是(填字母) 。 A. 50mL、50mL B. 100mL、100mL C.
100mL、150mL D. 250mL、250mL (4)写出有关的化学方程式
。 (5)胃药中含碳酸钙的质量是
。 试题详情
19.(12分)可能由Fe203、Fe、CuO、C、AI中的几种物质组成的混合粉末,取样进行下列实验(部分产物略去): 试题详情

(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通人C02,无明显变化,说明样品中不含有的物质是(填化学式)
。 (2)Z为一种或两种气体: ①若z只为一种气体,试剂a为饱和NaHCO3溶液,则反应I中能同时生成两种气体的化学方程式是
。 ②若z为两种气体的混合物,试剂a为适量的水,则Z中两种气体的化学式是 。 (3)向Y中通入过量的Cl2,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)
。 (4)取Y中的溶液,调节pH约为7,加入淀粉KI和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2molIˉ1时,共转移3mol电子,该反应的离子方程式是
。 (5)另取原样品,加入足量稀硫酸充分反应,若溶液中一定不会产生Y中的红色固体,则原样品中所有可能存在的物质组合是(各组合中物质用化学式表示)
。 试题详情
 20. (10分)500℃、20MPa时,将H2和N2置于一容积为2I。的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示,根据题意完成下列各题: 20. (10分)500℃、20MPa时,将H2和N2置于一容积为2I。的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示,根据题意完成下列各题:
(1) 500℃、20MPa时,反应处于平衡状态的时间 ;
。 (2)反应开始到第一次平衡时,N2的平均反应速率为
。 (3)据图判断,反应进行到10min至20min时曲线发生变化的原因是:
;反应进行至25min时,曲线发生变化的原因是: 。 试题详情
21.(10分)在10L密闭容器中充人lmolN2O4,在某条件下反应进行到4min时达到化学平衡,测得每1L混合气体中含NO2,3.68g。则: (1)下列选项中不能判断混合气体达到平衡的是 (填序号); A.混合气体的颜色不再改变 B. 混合气体的密度不再改变 C. 混合气体的压强不再改变
Tesoon.com 天星版权 E. NO2的反应速率是N2O4反应速率的两倍 F.当有2mol NO2消耗的同时有lmol N2O4消耗 (2)NOz的生成速率为
; (3)N。O。的转化率为
; (4)平衡时容器内的压强是原来的
; (5)平衡时混合气体的平均相对分子质量为
。
试题详情
22.(10分)在一定温度下,把8体积SO2和4体积O2通入一个有活塞的体积可变的容器中,活塞一端与大气相通(如图所示)。容器内发生下列反应:2SO2(g)+O2(g)== 2SO3(g); ,当反应达到平衡后,测得混合气体为10体积。 ,当反应达到平衡后,测得混合气体为10体积。 试题详情
 (1)保持上述温度不变,设a、b、c分别代表初始加入的SO2、O2和SO3气体的体积,如果反应过程达到平衡时,混合气体的体积仍为10体积且各物质的含量与上述平衡相同,那么: ①若a= 3,c=5,则b=6 。在此情况下反应起始时正反应速率将
(填“大于”、“小于”或“等于”)逆反应速率。 ②若欲使起始时正反应速率大于逆反应速率,则c的取值范围为
。 (2)在反应容器中,若起始时“、b.c值均与(1)相同,但须控制平衡时混合气体为9体积,则可采取的措施是
,原理是
湖南师大附中2009届高三第四次月考 化 学 答 案 题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 答案 D B C B A D B B C A C B C C D A 试题详情
试题详情
2.【解析】先算出用c表示的速率,再换算成用A、B表示的。题中A为0.5 mol,B为0.4 不是实际反应的物质的量,不能用于计算。 试题详情
3.【解析】C中:c(H+)=10ˉ12 molˉ1 ?Lˉ1的溶液为碱性溶液时,可以与K+、Ba2+、Clˉ、Brˉ都共存;A中使酚酞试液变红的溶液为碱性溶液,与Fe3+件不共存;B中使紫色石蕊试液变红的溶液为酸性溶液,与Fe2+ ,NO3ˉ发生氧化还原反应不共存;D中碳酸氢钠溶液与H+不共存。 试题详情
5.【解析】向右建立平衡的过程使得混合气体的平均摩尔质量增大 ,而总质量不变,则 ,而总质量不变,则 混合气体的总物质的量减小,则有化学计量数关系为:3十l>n+2,n<2,所以n只能取1。 试题详情
6.【解析】因为方程式中A的系数为n,n值不确定,所以不知道平衡向哪个方向移动,因此无法比较。 试题详情
7.【解析】用极限转化法将NH3全部转为H2和N2就可以比较了。 试题详情
8.【解析】是合成氨条件选择的拓展延伸,选择适宜温度、高压、催化剂,是综合考虑催化活性、反应速率、平衡移动等多方面原因。 试题详情
9.【解析】NH。C1晶体的加入使氨水的电离平衡向逆反应方向移动。
|
试题详情
11. 【解析】因为磷酸是弱酸,所以无法全部电离。 试题详情
12. 【解析】加水稀释后,c(H+)减小,因为水的离子积不变,所以c(OHˉ)将增大。 试题详情
13. 【解析】HCl、HBr、HI酸性依次增强。 试题详情
14. 【解析】用n(H+)=n(OHˉ)计算, ,所以碱溶液c(OHˉ)= ,所以碱溶液c(OHˉ)=  ,pH等于14-3.5=10.5 ,pH等于14-3.5=10.5 试题详情
15.【解析】D中为电荷守恒:c(Na+)+ (H+)=2(S2ˉ)+ c(HSˉ)+c(0Hˉ). 试题详情
16.【解析】解题关键是溶液为酸性,则c(H+)>c(OHˉ),c错。pH=3的CH3COOH,酸的浓度远远大干 ,Ph=11的NaOH,碱的浓度等于 ,Ph=11的NaOH,碱的浓度等于 ,酸过量,所以A对,B错。 ,酸过量,所以A对,B错。 试题详情
17. (1)水的电离是吸热过程,温度升高,水的电离平衡右移。 (2)1:1;9:11 试题详情
18. (1)①②④③②④③或②①④③②④③(要滴定2次) (2)A、C;玻璃棒、烧杯 (3)B (4)CaCO3+HCl====CaCl2+CO2↑+H2O HCl+
NaOH====NaCl+H2O 试题详情
(5) 试题详情
试题详情
(2)C+2H2SO4(浓)== =CO2↑+2SO2↑+2H2O =CO2↑+2SO2↑+2H2O (3)Cu2+、Fe3+、H+ (4)2Fe2++3H2O2+4Iˉ====2Fe(OH) 3↓+2I2 (5)CuO、C;CuO、C、Fe2O3 试题详情
试题详情
(2)0.00375mol/(L?min) (3)加入催化剂;移去部分NH。或使部分NH4液化。 试题详情
21.
|
试题详情
(2)0.02 mol/(L?min) (3)40% 试题详情
试题详情
试题详情
试题详情
(1)1.5;小于;4>c≥0 (2)降低容器内温度;降低温度使平衡向放热反应方向移动,从而使气体体积减小。 试题详情
 天星教育网(www.tesoon.com)
版权所有
天星教育网(www.tesoon.com)
版权所有
天星教育网(www.tesoon.com)
版权所有 天星教育网(www.tesoon.com)
版权所有
| | | | | | | 