
平均分子量在化学平衡计算中的应用
文/杨基鄂
??化学平衡计算题的类型主要有:求转化率、求混合气体中各组分的质量分数、求平衡时混合气体的压强、求化学方程式的计量数、求平衡时混合气体的平均分子量等。笔者就最后一类题的解题方法和计算实例作以下归纳。
??一、混合气体平均分子量的数学表达式
??1. =M1×V1%+M2×V2%+M3×V3%+…式中
=M1×V1%+M2×V2%+M3×V3%+…式中 表示混合气体的平均分子量。
表示混合气体的平均分子量。
??M1,M2,M3分别表示混合气体中各组分的相对分子质量。V1%,V2%,V3%分别表示混合气体中各组分的体积分数。
??2.在相同条件下,气体的体积分数等于气体的物质的量分数(组分气体的物质的量与混合气体总物质的量之比)因此该数学表达式又可为:
? =M1?n1+M2?n2+M3?n3+…
=M1?n1+M2?n2+M3?n3+…
式中n1,n2,n3分别表示混合气体中各组分气体的物质的量分数。
3.已知混合气体在标准状况下的密度ρ或相对密度D,则平均分子量可通过下式计算:
? =ρ?22.4?
=ρ?22.4? =M?D(m为某气体的相对分子质量)
=M?D(m为某气体的相对分子质量)
4.已知混合气体的总质量和混合气体的总物质的量则平均分子量还可以通过下式计算:
? =(m总/n总)
=(m总/n总)
m总为混合气体的总质量;n总为混合气体的总物质的量。
二、计算实例
例1.在一定条件下将物质的量相等的NO和O2混合发生如下反应:2NO+O2 2NO2,2NO2
2NO2,2NO2 N2O4。所得混合气体中NO2的体积分数为40%,混合气体的平均式量为( )。
N2O4。所得混合气体中NO2的体积分数为40%,混合气体的平均式量为( )。
A.49.6 ?B.41.3 ?C.62 ?D.31
解:设起始NO物质的量为x:
?2NO+O2 2NO2 则剩余O2的体积为:
2NO2 则剩余O2的体积为:
?2 1 2
?x x/2 x ?VO2=x/2mol
设生成的NO2有ymol转化成N2O4
? ?2NO2 N2O4
N2O4
?起始物质的量 ? x? ? ??0
?转化物质的量 ??2y ? ??y?
?平衡物质的量 ??x-2y? ?y?
混合气体总物质的量为
?n总=x-2y+y+(x/2)=x+(x/2)-y?
依题意有:(x-2y/x+(x/2)-y)=(40/100)
解得?x=4y
∴ =(32×(x/2)+46(x-2y)+92×y/x+x/2-y)
=(32×(x/2)+46(x-2y)+92×y/x+x/2-y)
=(64y+184y/5y)=49.6
答:选A。
例2.某温度下N2O4和NO2之间建立起如下的平衡N2O4 2NO2,测得平衡混合物对空气的相对密度为2.644,求N2O4的分解率。
2NO2,测得平衡混合物对空气的相对密度为2.644,求N2O4的分解率。
解:设N2O4的起始物质的量为1
转化了的N2O4物质的量为x
???????N2O4 2NO2
2NO2
起始物质的量??1?????0
转化物质的量??x????2x
平衡物质的量??1-x???2x
平衡时混合气体的总物质的量为
n总=1-x+2x=1+x
∵ =29?D=29×2.644=76.68
=29?D=29×2.644=76.68
已知N2O4和NO2的相对分子质量分别为92,46,则有:
76.68=(92×(1-x)+46×2x/1+x)
解得x=0.2mol
∴N2O4的分解率为:(0.2/1)×100%=20%
答:N2O4的分解率为20%。
例3.在10L密闭容器中,放入8.0gSO3在一定条件下反应:2SO3(g) 2SO2(g)+O2(g)并达到平衡状态,SO3的分解率为40%,求平衡混合气密度是相同条件下H2密度的多少倍?
2SO2(g)+O2(g)并达到平衡状态,SO3的分解率为40%,求平衡混合气密度是相同条件下H2密度的多少倍?
解:2SO3(g) 2SO2(g)+O2(g)
2SO2(g)+O2(g)
起始物质的量/mol 0.1 ? ?0 ? ?0
转化物质的量/mol 0.04 ? 0.04 ? ?0.02
平衡物质的量/mol 0.06 ? 0.04 ? ?0.02
∴?n总=0.06mol+0.04mol+0.02mol
?=0.12mol
 =(m总/n总)=(8.0/0.12)=66.67
=(m总/n总)=(8.0/0.12)=66.67
∴( /MH2)=(66.67/2)=33.34
/MH2)=(66.67/2)=33.34
答:平衡时混合气密度是相同条件下H2密度的33.34倍
例4.SO2与O2混合气体对H2的相对密度为22.22,在密闭容器内反应达到平衡,平衡混合物对H2的相对密度为26.92。求SO2的转化率。
解:反应前 前=22.22×2=44.44
前=22.22×2=44.44
反应后 后=26.92×2=53.84
后=26.92×2=53.84
设原混合气体含SO21mol,含O2xmol
则有:44.44=(64×1+32×x/(1+x))
解得x=1.572mol
设SO2的转化率为y,则有:
2SO2+O2 2SO2??Δn
2SO2??Δn
2 1 2 1
1×y? 0.5y ?
53.84=(64×1+32×1.572)/[(1+1.572)-0.5y]
解得:y=0.898=89.8%
答:SO2的转化率为89.8%
例5.在 2NO2并达到平衡,此时测得容器内混合气体的密度比原来减少1/3(温度和压强不变)。计算:
2NO2并达到平衡,此时测得容器内混合气体的密度比原来减少1/3(温度和压强不变)。计算:
(1)N2O4的分解率;
(2)平衡混合物的平均分子量。
解:依题意nN2O4=(18.4g)/92g/mol=0.2mol
平衡混合气密度比原来减少1/3
∴(n起始/n平衡)=(ρ平衡/ρ起始)
=(2/3/1)=(2/3)
则有:n平衡=(3/2)n起始=(3/2)×0.2mol=0.3mol
(1)设N4O4分解率为x,则有:
N2O4 2NO2??Δn
2NO2??Δn
1??????2????1
0.2xmol?????(0.3mol-0.2mol)
解得?x=(0.1mol/0.2mol)=0.5=50%
(2)m总=18.4g
n总=0.3mol
 =(m总/n总)=(18.4/0.3)=61.33
=(m总/n总)=(18.4/0.3)=61.33
答:(1)N2O4的分解率为50%;
(2)平衡时混合气体的平均分子量为61.33。
例6.工业上有一反应2A(g)+B(g) 3C(g),按体积比为A∶B=5∶2将A和B充入到一定容积的密闭容器中,若在恒温条件下达到平衡时C占总体积的60%,设A,B,C的相对分子质量分别用a,b,c表示。试求:
3C(g),按体积比为A∶B=5∶2将A和B充入到一定容积的密闭容器中,若在恒温条件下达到平衡时C占总体积的60%,设A,B,C的相对分子质量分别用a,b,c表示。试求:
(1)平衡时A和B的转化率。
(2)平衡时混合气体的平均分子量。
解:(1)设A=5V,则B=2V。
设B转化了x,则有:
2A(g)+B(g) 3C(g)
3C(g)
起始 5V 2V? 0
转化 2x x 3x?
平衡 5V-2x 2V-x 3x
依题意有:
(3x)/[(5V-2x)+(2V-x)+3x]
??=(60/100)=(3/5)
即有:(3x/7V)=(3/5)
解得:x=(7V/5)
∴A的转化率为:
A%=(2x/5V)×100%=(2×7/5V)/5V×100%
?=56%
B的转化率为
B%=(x/2V)×100%=(7/5V)/2V×100%=70%
(2)混合气体平衡时的总体积V总=7L
 =(5aL+2bL)/7L=(5a+2b)/7
=(5aL+2bL)/7L=(5a+2b)/7
答:(1)平衡时A的转化率为56%;
B的转化率70%;(2)平衡时混合气体的平均分子量为(5a+2b)/7。
例7.在一定温度下将100mLN2,H2混合气充入密闭恒压容器内,发生反应达到平衡时维持温度不变,测得混合气的密度是反应前密度的1.25倍,平均分子量为15.5。求平衡时N2的转化率;N2,H2两种气体开始时各为多少毫升?
解:∵同T同P下有(ρ1/ρ2)=(m1/m2)
∴有(1/1.25)=(m1/15.5)?解得m1=12.4
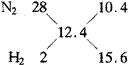
(V1/V2)=(n1/n2)
即:?VN2∶VH2=10.4∶15.6
∴?VN2=10.4/(10.4+15.6)×100mL=40mL
??VH2=100mL-40mL=60mL
设N2转化的体积为x,则有:
?????N2? + ?3H2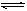 2NH3
2NH3
起始体积 40 60 0
转化体积 x 3x 2x
平衡体积 40-x 60-3x 2x
?V总=40-x+60-3x+2x=100-2x
∴有:
15.5=((40-x)×28+(60-3x)×2+2x×17)/(100-2x)
解得?x=10mL
∴N2的转化率为:
N2%=(10/40)×100%=25%
答:平衡时N2的转化率为25%;N2,H2两种气体开始的体积分别为40mL和60mL。
例8.可逆反应C(s)+H2O(g)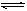 CO(g)+H2(g)-Q达到平衡后,改变温度使平衡发生移动,气体的平均分子量如何变化?
CO(g)+H2(g)-Q达到平衡后,改变温度使平衡发生移动,气体的平均分子量如何变化?
解:该反应中当温度改变使平衡移动时,每增加(或减小)1mol(或xmol)气体,气体的质量就增加(或减小)12g(或12xg)
设原平衡时气体的总质量为m(m>12x),气体总物质的量为n(n>x)。
则有?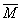 =(m/n)
=(m/n)
当温度升高、平衡右移后,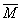 =(m+12x)/(n+x)?
=(m+12x)/(n+x)?
当温度降低、平衡左移后,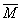 =(m-12x)/(n-x)
=(m-12x)/(n-x)
(1)温度升高平衡右移时:
[(m+12x)/(n+x)]-(m/n)=[x(12n-m)]/[n(n+x)]
讨论:
①若m>12n,则12n-m<0?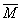 减小;
减小;
②若m=12n,则12n-m=0?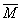 不变;
不变;
③若m<12n,则12n-m>0?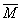 增大。
增大。
(2)温度降低平衡左移时:
讨论:
①若m>12n,则12n-m<0?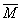 增大;
增大;
②若m=12n,则12n-m=0?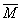 不变;
不变;
③若m<12n,则12n-m>0?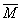 减小。
减小。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com