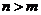+ n HOCH2CH2OH [ OC― ―COOCH2CH2O ]n
+nH2O nHOOC― ―COOH
试题详情
试题详情
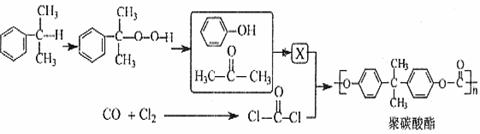
请写出: (1)X的结构简式___________。 试题详情
(2)在一定条件下X与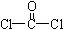 反应合成聚碳酸酯的化学方程式(不必写反应条件): 反应合成聚碳酸酯的化学方程式(不必写反应条件): _________________________________________________。 (3)X和浓溴水反应时,1mol X最多消耗Br2__________mol。 试题详情
(4)属于苯的同系物,与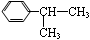 互为同分异构体的有机物有 种。 互为同分异构体的有机物有 种。 七.(本题包括2小题,共18分) 试题详情
24.(6分)某芳香族化合物与苯酚无论以何种比例混合,只要总物质的量一定,完全燃烧时所消耗的氧气和生成水的质量始终一定。试回答: ⑴这类物质的相对分子质量与苯酚的相对分子质量之差为_________的倍数(填数字)。 试题详情
⑵现有这类物质中相对分子质量最小的物质A,已知A溶液能与NaHCO3反应放出气体。现取2.32g苯酚与A的混合物与50.0mL1.000mol/L的NaOH溶液充分反应后,加水至100mL。取出其中的10.0mL用0.100mol/L的HCl溶液滴定过量的NaOH,消耗20.0mL时至滴定终点。求该混合物中苯酚的质量分数(结果保留三位有效数字)。 试题详情
25.(12分)钴(Co)化合物对化学键的研究起着重要的作用。为测定某钴化合物[Co(NH3)x
Cly]Clz的组成,进行如下实验: 试题详情
①
称取样品0.5010g ,加入过量的NaOH溶液,煮沸,蒸出所有的氨,冷却,得到A。产生的氨用50.00mL 0.5000mol?L―1 的盐酸完全吸收并用蒸馏水定容到100mL,得溶液B,取B溶液20.00mL , 用0.1000mol?L―1 NaOH滴定,消耗NaOH溶液30.00mL。 ②
向A中加入过量的KI固体,振荡,盐酸酸化后置于暗处,发生反应: Com+ + I― → Co2+ + I2(未配平) 试题详情
反应完成后,蒸馏水稀释,用Na2S2O3溶液滴定析出的I2,消耗0.1000mol?L―1Na2S2O3溶液20.00mL 。反应方程式为:I2 + 2Na2S2O3
= 2NaI + Na2S4O6 试题详情
③
另称取该物质样品0.2505g,溶于水,以0.1000mol?L―1AgNO3溶液滴定至恰好反应完全,消耗AgNO3溶液20.00mL。相应反应式为: [Co(NH3)x Cly]Clz +
zAgNO3=[Co(NH3)x Cly](NO3)z
+ zAgCl↓ 通过计算求: ⑴[Co(NH3)x Cly]Clz中氮元素的质量分数。 ⑵该钴化合物的化学式。 2009届江苏省泰州市期末联考高三化学模拟试题 试题详情
一、选择题(每小题4分,共32分) 题号 1 2 3 4 5 6 7 8 答案 A B C D D B C C 二、选择题(每小题4分,共32分) 题号 9 10 11 12 13 14 15 16 答案 B BD AD B BD C AD AD 三、(本题包括2小题,共22分) 17.(每小条2分)(1)150mL,气体体积为110mL,量筒的量程越小,产生的误差越小; (2)酸式滴定管,酸性KMnO4具有强氧化性,能腐蚀碱式滴定管的乳胶管; (3)B,防止气体冷却时发生倒吸现象;此时读数由于量筒中气体压强小于外界大气压,使读的气体体积偏大,Na2O2纯度偏高;应慢慢把量筒往下移,使量筒中液面恰好与水槽中液面相平; (4)溶液刚好出现浅紫红色,并在半分钟内不褪色; (5)62.4%  18. 18.
四、(本题包括2小题,共18分) 19.(1)S1>S3>S2>S4(2分)(2)①b ②c (各1分,共2分) (3)①HClO4(1分)②离子键、(极性)共价键(1分) NaClO(1分) ③SiO2+2C Si+2CO↑(1分) Si+2CO↑(1分) 20.(1)D为FeSO4(2分),E为H2S
(2分) (2)离子方程式2Fe3++SO2+2H2O=2Fe2++4H++SO42-(2分) (3)离子方程式2Cu2++2H2O 2Cu+4H++O2↑(2分) 2Cu+4H++O2↑(2分) (4)称一定量的Cu2S和CuS充分燃烧,再称燃烧后的产物,若燃烧后的质量和反应物的质量相等,则被燃烧的物质是Cu2S,若燃烧后的质量比原来的反应物质量少,则被燃烧的物质是CuS。(2分) 五、(本题包括1小题,共10分) 21.(1)温度升高,促进电离,所以K值增大(2分) (2)K值越大,电离出的氢离子浓度越大,所以酸性越强(2分) (3)H3PO4 HPO42―(2分) (4)K1:K2:K3≈1:10―5:10―10 (2分) 上一级电离产生的H+对下一级电离有抑制作用 (2分) 六、(本题包括2小题,共18分)   22.(8分)(I)C2nH3nPn
。 22.(8分)(I)C2nH3nPn
。
(II)C20H30O2, 23.(10分) (1) (3分)
(2)略(3分) (3)4(2分)
(4)7(2分) (3分)
(2)略(3分) (3)4(2分)
(4)7(2分)
七、(本题包括2小题,共18分) 24.(6分)(1)44 (2分) (2)A分子中含一个羟基和一个羧基,1molA消耗2molNaOH n(HCl)= 0.02 L×0.100mol/L= 0.002mol (1分) 。苯酚与A的混合物消耗的NaOH物质的量为:0.05L×1.000mol/L―0.002mol× =0.03mol (1分) 依题意可得: =0.03mol (1分) 依题意可得:  n(C6H5OH)+2×n(A)=0.03mol n(C6H5OH)+2×n(A)=0.03mol
94 g/mol×n(C6H5OH)+138g/mol×n(A)=2.32 g n(C6H5OH)=0.01mol m(C6H5OH)=0.94g w (C6H5OH)= ×100%=40.5%(或0.405) (2分) ×100%=40.5%(或0.405) (2分) 25.⑴(共4分)NaOH+HCl=NaCl+H2O NH3+HCl=NH4Cl 20.00mLB溶液消耗0.1000mol?L-1NaOH 30.00mL。 20.00mLB溶液中过量的HCl:n(HCl)=0.003000mol , 100mLB溶液中过量的HCl:n(HCl)=0.01500mol那么与NH3反应的n(HCl)=0.01000mol 故0.5010g样品中
n(NH3)=0.01000mol
n(N)=0.01000mol(2分) [Co(NH3)xCly]Clz中氮元素的质量分数  (2分) (2分)
⑵(共6分)I2+2Na2S2O3==2NaI+Na2S4O6 因反应用去0.1000mol?L-1Na2S2O3溶液20.00mL,推算出:n(I2)=0.001000mol(1分) Co与Fe同一族,Com+具有强氧化性,故设m=3 则有:2Co3++2I-==2Co2++I2 n(Co3+)=0.002000mol (1分) 0.5010g样品中Cl的总质量为: m(Cl)=0.5010g-0.002000molx59g?mol -1-0.01000molx17g ?mol
-1=0.2130g n(Cl)=0.006000mol(1分) 又有:[Co(NH3)xCly]Clz+zAgNO3==[Co(NH3)xCly](NO3)z+zAgCl↓ 0.2505g样品扩大一倍来算(即用0.5010g)推算出: 反应消耗AgNO3:n(AgNO3)=0.1000mol?L-1x40.00mL=0.004000mol 即发生上述反应的Cl-为:n(Cl-)
=0.004000mol(1分) 则有 y:z=(0.006000mol-0.004000
mol): 0.004000mol=1:2 同时还有:1:x:(y+z)= 0.002000: 0.01000:
0.006000=1:5:3 解得:x=5 y=1 z=2 带入[Co(NH3)xCly]Clz中,求得Co化合价为:+3 假设成立 该钴化合物的化学式为:[Co(NH3)5Cl]Cl2(3分) 答:⑴[Co(NH3)xCly]Clz中氮元素的质量分数为27.94% ⑵该钴化合物的化学式为:[Co(NH3)5Cl]Cl2
| 
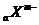 和
和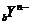 具有相同的电子层结构,若
具有相同的电子层结构,若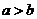 ,则
,则