Tesoon.com
天星版权
1.化学与生产、生活、社会密切相关。下列有关说法中不正确的是( )www.ks5u.com
A.2008年北京奥运会开幕式上的“脚印”等焰火让全世界为之欢呼、倾倒,这主要是利用了化学中“焰色反应”的有关知识。
 B.神七宇航员所穿航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料。
B.神七宇航员所穿航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料。
C.三鹿毒奶粉中的三聚氰胺是一种“伪蛋白”, 幼儿长期摄入会造成尿路结石等。
三聚氰胺分子结构如右图所示,其化学式为C3H6N6,是一种氨基酸。
D.2008年诺贝尔化学奖被授予研究“绿色荧光蛋白质”的美籍华裔科学家钱永健等人。天然蛋白质都是由氨基酸形成的可降解的高分子化合物,其水溶液有丁达尔效应。
2.物质世界中有很多变化是由物理变化造成的。以下变化或过程属于物理变化的是( )
A.激光法蒸发石墨得
B.光束通过 胶体产生丁达尔效应
胶体产生丁达尔效应
C.鸡蛋白遇浓硝酸显黄色
D.向沸水中滴入FeCl3饱和溶液,煮沸至溶液呈红褐色
3.金属钛对体液无毒且有惰性,能与肌肉和骨骼生长在一起,因而有“生物金属”之称。下列有关 和
和 的说法中正确的是( )
的说法中正确的是( )
A. 和
和 中子数相同
中子数相同
B. 和
和 核外均有22个电子
核外均有22个电子
C.分别由 和
和 组成的钛单质互称为同分异构体
组成的钛单质互称为同分异构体
D. 与
与 为同一核素
为同一核素
4.下列关于有机物的说法正确的是( )
A.乙醇、乙烷和乙酸都可以与钠反应生成氢气
B.苯和乙烯都可使溴的四氯化碳溶液褪色
C.石油分馏可获得乙酸、苯及其衍生物
D.75%的乙醇溶液常用于医疗消毒
5.下列实验不能达到目的的是( )
A.用四氯化碳萃取碘水中的碘
B.加热氯化铵与氢氧化钙固体混合物制取氨气
C.用二氧化锰和稀盐酸反应制取氯气
D.向酸性KMnO4溶液中通入乙烯验证乙烯的还原性
6.下列化学反应在冶金工业中没有得到广泛应用的是( )
A. (熔融)
(熔融)
B.
C.
D.
7.下列各项中指定的粒子数目约为6.02
 的是( )
的是( )
A.1.2 g 12C所含的电子数
B.常温下1.7 g NH3所含的共价键数
C.1L 0.1mol/L Na2SO3溶液中所含的SO32-个数
D.标准状况下2.24LSO2所含的分子数
8.能正确表示下列反应的离子方程式是( )
A.泡沫灭火器原理: Al3++3HCO3-===Al(OH)3↓+3CO2↑
B.硫酸铜与烧碱反应:CuSO4+2OH-===Cu(OH)2↓+SO42-
C.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+
D.碳酸钡与硫酸反应:Ba2++SO42-===BaSO4↓
9.在化学学习中使用数轴的表示方法可收到直观、形象的效果,下列表达中正确的是( )
 A.分散质微粒的大小与分散系种类的关系:
A.分散质微粒的大小与分散系种类的关系:

B.常温下溶液的pH其酸碱性的关系:

C.硫元素在化合物中的化合价与其氧化性、还原性的关系:
 D.Fe在
D.Fe在 中燃烧的产物与
中燃烧的产物与 的关系:
的关系:
R
X
Y
Z
10.右图为周期表中短周期的一部分,若X原子最外层电子数比次外层电子数少3,则下列说法正确的是
A.X的氢化物比R的氢化物稳定
B.原子半径大小顺序是Z>Y>X>R
C.Z的单质能与Y的某些化合物发生置换反应
D.X、Z可形成化合物XZ5,分子中各原子均满足最外层8电子结构
11.元素A的单质 及A与B形成的化合物能按下图所示的关系发生转化。 则下列说法不正确的是( )
及A与B形成的化合物能按下图所示的关系发生转化。 则下列说法不正确的是( )
A.A一定是金属元素
B.当n=1时,A可能位于周期表第二周期
C.图中物质间的转化都是氧化还原反应
D.当n=2时,A可能是Fe
12.已知在25。C  时:CH4(g)+2O2(g)→CO2(g)+2H2O(g) △H= -820 kJ/mol
时:CH4(g)+2O2(g)→CO2(g)+2H2O(g) △H= -820 kJ/mol
则下列说法中正确的是( )
A.该反应发生断裂的化学键只有极性键
 B.11.2L CH4完全燃烧生成气态水时一定放出410 kJ 热量
B.11.2L CH4完全燃烧生成气态水时一定放出410 kJ 热量
C. 的燃烧热为820 KJ/mol
的燃烧热为820 KJ/mol
D.反应过程中的能量变化关系可用右图表示
13.某同学按右图所示的装置进行试验。 A 、 B 为两种常见金属,它们的硫酸盐可溶于水。当 K 闭合时,溶液中SO42一在阴离子交换膜处从左向右移动。下列分析不正确的是( )
 A.ASO4溶液中,c(A2+)减小
A.ASO4溶液中,c(A2+)减小
B.B 的电极反应: B-2e一==B2+
C. x电极上有 H2
产生,发生还原反应
D.反应初期,y 电极周围出现白色胶状沉淀,不久沉淀溶解
14.工业上以铬铁矿(主要成分FeO?Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7?2H2O)的主要反应为:① 4FeO?Cr2O3+8Na2CO3+7O2 8Na2CrO4+2
8Na2CrO4+2 +8CO2
+8CO2
② 2Na2CrO4+H 2SO4=Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
A.反应①和②均为氧化还原反应
B. 内物质是Fe3O4
内物质是Fe3O4
C.反应①的氧化剂是O2,还原剂是FeO?Cr2O3
D.生成l mol的Na2Cr2O7共转移6 mol电子
15.下列溶液中离子浓度的关系一定正确的是( )
A.Na2CO3和NaHCO3混合溶液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-)
B.一元弱碱MOH对应的盐MCl溶液中:c(Cl-)>c(H+)>c(M+)>c(OH-)
C.等物质的量的一元弱酸HX与其钾盐KX的混合溶液中:2c(K+)=c(X-)+c(HX)
D.常温时pH=3的一元酸HX和pH=11的一元碱MOH等体积混合后一定有:
c(M+)=c(X-)>c(H+)=c(OH-)
16.已知通过乙醇制取氢气有如下两条路线:
a.CH3CH2OH(g)+H2O(g)→4H2(g)+2CO(g) △H=+ 255.6 kJ/mol
b.CH3 CH2OH(g)+ O2(g)→3H2(g)+2CO(g)△H= + 13.8 kJ/mol
O2(g)→3H2(g)+2CO(g)△H= + 13.8 kJ/mol
则下列说法不正确的是( )
A.升高温度,可提高a路线中乙醇的转化率
B.从能量消耗的角度来看,b路线制氢更加有利
C.乙醇可通过淀粉等生物质原料发酵制得,属于可再生资源
D.由a、b知: H2 O(l)=== H2(g)+ O2(g) △H= + 241.8 kJ/mol
O2(g) △H= + 241.8 kJ/mol
17.现有常温下的四种溶液(如下表),下列有关叙述中正确的是( )
①
②
③
④
溶液
氨水
氢氧化钠溶液
醋酸
盐酸
pH
11
11
3
3
A.在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变
B.分别加水稀释10倍后,四种溶液的pH:①>②>④>③
C.温度下降10℃,四种溶液的pH均不变
D.将①、④两种溶液等体积混合,所得溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
 18.某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)
18.某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g) 2AB3(g)
2AB3(g)
化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的是( )
A.a点时V正>V逆
B.达到平衡时A2的转化率大小为:c>b>a
C.正反应一定是吸热反应
D.其他条件不变,若从b点平衡起增加B2的量达到新的平衡,AB3的体积分数减小,平衡逆向移动
2,4,6 注意事项:本卷共5题,共54分。 二、本题包括1小题,共12分。 19.硫酸亚铁铵晶体[(NH4)2Fe(SO4)2?6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂,其实验室制备流程如下: 试题详情
回答下列问题: (1)Na2CO3溶液可以除去铁屑表面油污,是因为Na2CO3溶液显碱性,能使油污水解。用离子方程式表示Na2CO3溶液显碱性的原因: ______________
。 (2)判断铁屑与硫酸基本反应完全的现象是____________________________。 (3)操作Ⅰ和操作Ⅱ都需要用到的玻璃仪器是 。 (4)操作Ⅰ后的溶液有时略显黄色,分析其可能原因是(用离子方程式表示) ______________
。 (5)忽略油污质量,本实验中应称量(NH4)2SO4固体的质量为_______ g。 (6)若上述流程用于大量生产,从提高原料利用率角度分析,得到产品后的母液最佳处理方法是_______________
。 试题详情
三、本题包括2小题,共14分。 20.(6分)A、B、C、D、E五种短周期元素,核电荷数依次增加,其中A与D同主族,C与E同主族。A的一种原子内无中子,B原子最外层电子数是内层电子数的2倍,一个C2―离子含10个电子。 (1)D的单质在C的单质中燃烧,生成化合物甲。写出化合物甲的电子式
。 (2)由A、B两种元素组成最简式为BA3的化合物乙与C的单质在足量KOH溶液中形成燃料电池的负极反应式为
。 (3)由A、C、D、E四种元素按原子个数比1:3:1:1组成物质丙溶于水后溶液显酸性,则溶液中各种离子的浓度由大到小的顺序是
。 试题详情
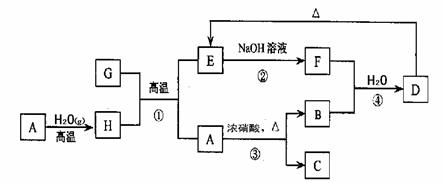 21.(8分)已知A、B、C、D、E、F、G、H 可以发生如下图所示的转化,反应中部分生成物已略去。 21.(8分)已知A、B、C、D、E、F、G、H 可以发生如下图所示的转化,反应中部分生成物已略去。
(1)
若A、G为同一主族元素的非金属单质,化合物B是一种能引起温室效应的气体。则反应③的化学方程式为
,反应④的离子方程式为
。 (2) 若A、G为生活中常见的金属单质,B是红棕色气体,D是一种白色胶状沉淀,则反应①的化学方程式为
, 反应②的离子方程式为
。 试题详情
四、本题包括1小题,共14分。 22.水煤气是重要的燃料和化工原料,可用水蒸气通过炽热的炭层制得: 试题详情
C (s) + H2O(g)  CO (g) +H2 (g)
△H= +131.3 kJ•mol-1 CO (g) +H2 (g)
△H= +131.3 kJ•mol-1 (1)该反应的平衡常数K随温度的升高而___________(增大 / 减小 / 不变)。 (2)上述反应达到平衡后,将体系中的C (s)移走一部分,平衡_______________(向左移 / 向右移 / 不移动)。 试题详情
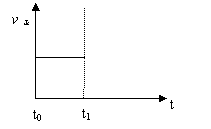 (3)上述反应在t0时刻达到平衡(如下图),若在t1时刻改变某一条件,请在下图中继续画出t1时刻之后正反应速率(ν正)随时间的变化: (3)上述反应在t0时刻达到平衡(如下图),若在t1时刻改变某一条件,请在下图中继续画出t1时刻之后正反应速率(ν正)随时间的变化:
① 缩小容器体积(用实线表示) ② 降低温度(用虚线表示) (4)相同温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。 容器编号 c(H2O)/mol?L-1 c(CO)/mol?L-1 c(H2)/mol?L-1 ν正、ν逆比较 I 试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
(5)己知:2C (s) + O2(g) = 2CO (g) △H =
-221.0 kJ?mo1-1 试题详情
2CO(g) + O2(g) = 2CO2 (g) △H =
-566.0 kJ?mo1-1 试题详情
2H2
(g) + O2 (g) = 2H2O
(g) △H = -483.6 kJ?mo1-1 若将24 g 炭完全转化为水煤气后再充分燃烧,整个过程放出的热量为
kJ。 五、本题包括1小题,共14分。 试题详情
23. 菠萝酯是一种具有菠萝气味的食用香料,是化合物甲与苯氧乙酸 -O-CH2-COOH发生酯化反应的产物。 -O-CH2-COOH发生酯化反应的产物。 (1)甲一定含有的官能团的名称是_________。 试题详情
(2)5.8g甲完全燃烧可产生0.3molCO2和0.3molH2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是______________________。 (3)苯氧乙酸有多种类型的同分异构体,其中能与FeCl3溶液发生显色反应,能与NaOH溶液发生水解反应,且苯环上有2种一硝基取代物的同分异构体是(写出任意1种的结构简式) _____________。 试题详情
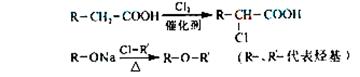 (4)已知: (4)已知:
菠萝酯的合成线路如下: 试题详情

①试剂X不可选用的是(选填字母)__________。 a、NaOH溶液 b、NaHCO3溶液 c、Na
②丙的结构简式是______________ ,反应Ⅱ的反应类型是_____________________。 ③反应Ⅳ的化学方程式是__________________________________________________。 临沂市2008―2009学年高三上学期期末考试
试题详情
1.C 2.B 3.B 4.D 5.C 6.B 7.D 8.A 9.C 10.C 11.A 12.D 13.C 14.C 15.C 16.D 17.B 18.B 19.(12分) (1)CO32- + H2O  HCO3- + OH- (2分) HCO3- + OH- (2分) (2)不再有气泡产生(或只有极少量气泡产生)(2分) (3)玻璃棒(2分) (4)4Fe2+ + O2
+ 4H+ = 4Fe3+ + 2H2O (2分) (5)6.6 (2分) (6)循环使用 (2分) 20.(6分) (1)Na+[ ]2- Na+ (2分) ]2- Na+ (2分) (2)C2H6-14e-+18OH-
=2CO32-+12H2O
(2分) (3) c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
(2分) 21.(8分) (1)C + 4HNO3(浓) CO2 ↑ + 4NO2 ↑ + 2H2O (2分,不写条件不得分) CO2 ↑ + 4NO2 ↑ + 2H2O (2分,不写条件不得分) SiO32-+CO2
+H2O = H2SiO3↓+CO32 (2分) (2)8Al+3Fe3O4 9Fe+4A12O3 (2分不写条件不得分) 9Fe+4A12O3 (2分不写条件不得分) Al2O3+2OH-=2AlO2-+H2O (2分) 22.(14分) (1)增大(2分) (2)不移动 (2分)  (3) (3)
(各占2分,起点位置、曲线走势、终点与原曲线的 相对高低等只要有一处错误则不得分。) (4)(4分) 0.60(2分) ν正_>_ν逆(2分) (5)787.0 (2分) 23:(14分) (1)羟基;(2分,写结构简式不得分)  (2)CH2=CH-CH2-OH;(2分) (2)CH2=CH-CH2-OH;(2分)
  (3)任意1种均可(2分) (3)任意1种均可(2分)
(4) ① b (2分)  ②ClCH2COOH,取代反应;(各2分) ②ClCH2COOH,取代反应;(各2分)
③
(2分
| |
