
专题三 离子方程式的书写及判断正误的方法
一、高考展望:
离子方程式的书写及判断正误是历年高考中必考的试题之一。主要以选择题形式出现。重点考查客观性原理、等电性原理、书写规则和规范原则。不过,也要注意反应物的物质的量之间的关系,哪种反应物过量的问题。从命题的内容上看,存在以下四个特点:
⑴所考查的化学反应均为中学化学教材中的基本反应,错因大都属于化学式能否拆分、电荷是否配平、产物是否合理和是否漏掉部分反应等;
⑵所涉及的化学反应类型以复分解反应为主,溶液中氧化还原反应所占比例较小。
⑶一些重要的离子反应方程式,在历年高考卷中多次重复。如:碳酸盐与酸反应,Na与H2O 反应,金属Al或Fe与盐酸或稀硫酸的反应等。
⑷根据信息或实验现象书写离子方程式。这类题型多贯穿在实验或简答题中。
二、考点归纳:
1. 判断离子方程式书写正误的方法:
⑴看离子反应是还符合客观事实,不事主观臆造产物及反应。
⑵看“==” “ ” “↓ ” “↑”等是否正确。
” “↓ ” “↑”等是否正确。
⑶看表示各物质的化学式是否正确。如HCO3- 不能写成 CO32- +H+ ,HSO4- 通常写成SO42-+H+ ,HCOO- 不可写成COOH ? 等。
⑷看是否漏掉离子反应。如Ba(OH)2 溶液与CuSO4 溶液反应,既要写Ba2+与SO42-的离子反应,又要写Cu2+与OH-的离子反应。
⑸看电荷是否守恒。如FeCl2 溶液与Cl2 溶液反应,不能写成Fe2++Cl2 ==2Fe3++2Cl-,应写成2Fe2++Cl2 ==2Fe3++2Cl-,同时两边的各原子数也应相等。
⑹看反应物与产物的配比是否正确。如稀H2SO4 与Ba(OH)2 溶液反应不能写成 H++OH-+SO42-+Ba2+==BaSO4↓+H2O ,应写成2H++2OH-+SO42-+Ba2+==BaSO4↓+2H2O 。
⑺看是否符合题设条件及要求。如“过量” “少量” “等物质的量” “适量” “任意量以” “滴加顺序”对反应方式或产物的影响。
2. 定量离子方程式的书写方法:
书写这类离子方程式时,首先要搞清反应物物质的量之比,若没告诉比例关系,则要弄清滴加顺序。
⑴开始滴加时,滴管中的反应物是不足量的,而锥形瓶(或烧杯等反应容器)中反应物过量。
①对于中和反应来说:
若碱过量,中和产物为正盐,
若酸或酸性气体在与碱反应时过量,可能生成酸式盐(对多元酸来说)。
②在氧化还原反应中:
若氧化剂过量,能被氧化的元素都将被氧化;
若氧化剂不足量,则还原性强的元素首先被氧化,就像Cl2和FeBr2溶液反应那样。
⑵要具体情况具体分析,看清题意,再写出符合题意的离子方程式。
例1. ⑴将少量NaOH溶液滴入过量的Ca(HCO3)2溶液中;
⑵将Ca(HCO3)2溶液与 NaOH溶液以溶质的物质的量之比1∶1混合;
⑶将Ca(OH)2溶液与NaHCO3溶液以溶质的物质的量比1∶1混合;
⑷少量NaHCO3溶液滴加到过量的Ca(OH)2溶液中。
以上离子方程式均可用下式来表示: OH-+Ca2++HCO3-=CaCO3↓+H2O
例2. ⑴过量的NaOH溶液与Ca(HCO3)2溶液反应;
⑵NaOH溶液与Ca(HCO3)2溶液以溶质的物质的量之比2∶1反应;
⑶Ca(OH)2溶液与NaHCO3溶液以溶质的物质的量比1∶2反应;
⑷Ca(OH)2溶液与过量的NaHCO3溶液反应。
其离子方程式均可用下式表示:2OH-+2HCO3-+Ca2+==CaCO3↓+2H2O+CO32-
例3. ⑴氢氧化钡和硫酸溶液反应(物质的量任意比);
⑵氢氧化钡和硫酸氢钠以溶质的物质的量之比1∶2反应;
―10―
⑶氢氧化钡溶液与过量的硫酸氢钠溶液反应。
均可用下式表示其离子反应:Ba2++ 2OH-+2H++SO42-==BaSO4↓+2H2O
例4. ⑴硫酸氢钠溶液和氢氧化钡溶液以溶质的物质的量比1∶1反应;
⑵NaHSO4溶液和过量的Ba(OH)2溶液反应。
均用下式表示其离子反应:Ba2++H++OH-+SO42-==BaSO4↓+H2O
例5. ⑴CO2与NaOH溶液以反应物物质的量之比1∶2反应;
⑵CO2通入过量的NaOH溶液中。
均用下式来表示其离子反应: CO2+2OH-==CO32-+H2O
请思考如下反应的离子方程式应如何表示:
⑴过量CO2通入NaOH溶液中: CO2+OH-==HCO-3 ;
⑵CO2与NaOH溶液以反应物物质的量之比1∶1反应: CO2+OH-==HCO-3 。
SO2跟NaOH溶液的反应呢?
例6. ⑴将少量盐酸滴入NaAlO2溶液中;
⑵NaAlO2溶液与盐酸以溶质的物质的量之比1∶1反应。
均可用下式表示其离子反应: AlO2-+H++H2O==Al(OH)3↓
例7. ⑴将少量NaAlO2溶液滴入盐酸溶液中;
⑵将NaAlO2溶液与盐酸溶液以溶质的物质的量之比1∶4反应。
均用下式表示其离子反应: AlO2-+ 4H+==Al3++2H2O
请思考如下反应的离子方程式应如何表示:?
⑴少量NaOH 溶液滴加到AlCl3溶液中: 3OH-+Al3+==Al(OH)3
⑵NaOH溶液与AlCl3溶液以反应物物质的量之比3∶1反应(同上)。
例8. ⑴将少量AlCl3溶液滴加到过量的NaOH溶液中;
⑵NaOH溶液与AlCl3溶液以反应物物质的量之比4∶1反应。
均用下式表示其离子反应: 4OH-+Al3+= AlO2-+2H2O
例9. ⑴将CO2通入过量的NaAlO2溶液中;
⑵CO2与NaAlO2以1∶2的物质的量比反应(在溶液中)。
其离子方程式均可用下式表示:CO2+2AlO2-+3H2O==2Al(OH)3↓+CO32-
请思考如下反应的离子方程式应如何表示:
⑴若将过量的CO2通入NaAlO2溶液中: CO2+AlO2-+2H2O==Al(OH)3+HCO3-
⑵CO2与NaAlO2以1∶1的物质的量之比在溶液中反应。(同上)
例10. ⑴将少量CO2通入Na2SiO3溶液中;
⑵CO2与Na2SiO3以物质的量之比1∶1反应。
其离子方程式均可用下式表示:CO2+SiO32-+2H2O== H4SiO4↓+CO32-
例11. KAl(SO4)2溶液和Ba(OH)2溶液反应:
①若两者物质的量之比是1∶2,则表示为:
_ Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+4AlO2-+2H2O
②若两者物质的量之比是2∶3,则表示为:
_ 2Al3++ 3SO4+ 3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
例12. 若将过量的Cl2通入FeBr2溶液中,其离子方程式为:
2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
若将少量的Cl2通入过量FeBr2溶液中,其离子方程式为:
Cl2+2Fe2+=2Fe3++2Cl- 或 2Cl2+2Fe2++2Br-==4Cl-+2Fe3++Br2 。
强调:书写离子方程式时一定要注意如下十个“不要”:
①不要忽视反应条件; ②不要忽视溶液的浓度;
③不要忽视方程式的电荷平衡; ④不要忽视电解质的强弱;
⑤不要忽视了电解质的溶解性; ⑥不要忽视了平衡理论;
⑦不要忽视难溶物溶解性大小的比较; ⑧不要忽视反应中的滴加次序;
⑨不要忽视方程式中系数的化简,当每一项都有公约数时才能化简;
⑩不要忽视反应中量的关系,不足量的反应物应按化学式中比例关系参加反应。
―11―
三、考点强训
一、选择题:
( D )1.下列反应的离子方程式正确的是
A.在硫酸铁溶液中加入足量氢氧化钡溶液:Ba2++SO42-==BaSO4↓
B.硫化钠水解:S2-+2H2O H2S+2OH-
H2S+2OH-
C.硫酸铜溶液中通入过量的硫化氢:Cu2++S2-===CuS↓
D.溴化亚铁溶液中通入过量氯气:2Fe2++4Br-+3Cl2===2Fe3++6Cl-+2Br2
( C )2. 下列反应的离子方程式书写正确的是
A.向饱和碳酸氢钙溶液中加入过量氢氧化钙溶液:
Ca2++2HCO3-+2OH-=CaCO3↓+2H2O + CO32-
B.金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑
C.用氢氧化钠溶液吸收二氧化碳:2OH-+CO2=CO32-+H2O
D.Mg(HCO3)2 溶液 与过量 NaOH 溶液反应:
Mg2++2HCO3-+2OH- = MgCO3↓+ CO32-+2H2O
(BC)3. 下列离子方程式正确的是
A.向Ba(OH)2溶液与稀H2SO4溶液发生中和反应:Ba2++OH―+H++SO42―==BaSO4↓+H2O
B.H2S通入FeCl3溶液中:2Fe3++S2―=2Fe2+ +S↓
C.碳酸氢钠溶液与硫酸氢钠溶液反应: HCO3―+H+==CO2↑+H2O
D.向漂白粉溶液中通入SO2: Ca2++2ClO―+SO2+H2O==CaSO3↓+2HClO
( C )4. 下列离子方程式中正确的是
A.过量的NaHSO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-= BaSO4↓+H2O
B.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O
C.苯酚钠溶液中通入少量CO2: -O-+CO2+H2O→
-O-+CO2+H2O→ -OH+HCO3-
-OH+HCO3-
D.FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2 = 2Fe3++Br2+4Cl-
( D )5. 下列反应的离子方程式错误的是
A.向碳酸氢钙溶液中加人过量氢氧化钠
Ca2++2HCO3-+2OH- = CaCO3↓+2H2O+CO32-
B.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合
Ba2++2OH-+NH4++HCO3- = BaCO3↓+NH3?H2O+H2O
C.氢氧化铝与足量盐酸反应 Al(OH)3+3H+ = Al3++3H2O
D.过量CO2通入氢氧化钠溶液中 CO2+2OH- = CO32-+H2O
( A )6.能正确表示下列反应的离子方程式是
A.硫化亚铁跟盐酸反应:FeS+2H+===Fe2++H2S↑
B.氯气跟水反应:Cl2+H2O===2H++Cl-+ClO-
C.钠跟水反应:Na+2H2O===Na++2OH-+H2↑
D.硫酸铜溶液跟氢氧化钡溶液反应:Ba2++SO42―===BaSO4↓
( A )7. 下列离子方程式中正确的是
A.向明矾溶液中加入Ba(OH)2溶液至A13+刚好完全沉淀:
Al3++ SO42-+3OH-+Ba2+===BaSO4↓+ A1(OH)3↓
B.氟气和水反应:2F2+2H2O===4H++4F-+O2
C.向澄清石灰水中加入少量小苏打溶液:Ca2++OH-+HCO3-===CaCO3↓+H2O
D.铜片投入稀HNO3溶液:Cu+NO3-+4H+===NO↑+2H2O+Cu2+
( C )8.下列离子方程式书写正确的是
A.溴化亚铁溶液中通入少量氯气: 2Br-+Cl2=Br2+2Cl-
B.在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7:
Ba2++OH-+H++SO42-=BaSO4↓+H2O
―12―
C.碳酸氢铵溶液与足量氢氧化钠稀溶液混合:
NH4++ HCO3-+ 2OH-= NH3?H2O + CO32-+ H2O
D.在漂白粉溶液中通入过量的二氧化碳气体Ca2+ +2ClO― +CO2 +H2O=CaCO3↓+2HClO
(AB)9.下列离子方程式不正确的是
A.碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑
B.稀硝酸中加入过量的铁粉: Fe +6H+ +3NO3-== Fe3+ +3NO2↑+3H2O
C.将金属钠加入水中:2Na+2H2O=2Na++2OH一+H2↑
D.将氯气通人氯化亚铁溶液中2Fe2++C12=2Fe3++2Cl一
( D )10.下列反应的离子方程式正确的是
A.向硅酸钠溶液中通入过量的二氧化碳气体:SiO32?+H2O+CO2=H2SiO3↓+CO32?
B.向Ca(ClO)2溶液中通入二氧化硫:Ca2++2ClO?+SO2+H2O=CaSO3↓+HClO
C.实验室用硫化亚铁与稀盐酸反应制取H2S气体:S2?+2H+=H2S↑
D.等体积等物质的量浓度的氯氧化钡与碳酸氢铵溶液混合:
Ba2++2OH?+NH4++HCO3?=BaCO3↓+NH3•H2O+H2O
( C )11. 下列反应的离子方程式不正确的是
A. 向烧碱溶液中滴加少量氯化铝溶液: Al3++4OH-==AlO2-+2H2O
B. 物质的量相等的溴化亚铁跟氯气反应:2Fe2++2Br-+2Cl2==2Fe3++Br2+4Cl-
C. 硫化钾晶体溶于水:S2-+2H2O==2OH-+H2S
D. 向碳酸钠溶液中滴加过量的稀硫酸:CO32-+2H+==CO2↑+H2O
( D )12. 下列离子方程式书写正确的是
A. 碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液:
Ca2++2HCO3-+2OH-==CaCO3↓+2H2O+CO32-
B. 碳酸钠溶液中加入等物质的量的乙酸:
CO32-+2CH3COOH==CO2↑+H2O+2CH3COO-
C. Ca(ClO)2溶液中通入过量的二氧化硫气体:
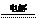 Ca2++2ClO-+H2O+SO2==CaSO3↓+2HClO
Ca2++2ClO-+H2O+SO2==CaSO3↓+2HClO
D. 用碳棒作电极电解氯化钠饱和溶液:2Cl-+2H2O 2OH-+Cl2↑+H2↑
(B )13. 下列离子反应方程式正确的是
A. 小苏打溶液中加入过量石灰水:2HCO3-+Ca2++2OH-==CaCO3↓+CO32-+2H2O
B. 氯化铝溶液中加入过量氨水:Al3++3NH3?H2O==Al(OH)3↓+3NH4+
C. 氯化亚铁溶液中通入氯气:Fe2++Cl2==Fe3++2Cl-
D. 苛性钾溶液中加入稀醋酸:H++OH-==H2O
(B )14. 下列反应的离子方程式书写正确的是
A. 金属钠跟水反应:Na+2H2O==Na++2OH-+H2↑
B. 向偏铝酸钠溶液中加入少量硫酸氢钠溶液:AlO2-+H++H2O==Al(OH)3↓
C. 澄清石灰水中滴入少量的NaHCO3溶液:
Ca2++2OH-+2HCO3-==CaCO3↓+CO32-+2H2O
D. 浓盐酸跟二氧化锰混合共热:MnO2+4H++4Cl- Mn2++2H2O+2Cl2↑
Mn2++2H2O+2Cl2↑
(AD)15. 下列离子方程式的书写正确的是
A. 过量二氧化碳通入偏铝酸钠溶液中:CO2+2H2O+AlO2-==Al(OH)↓+HCO3-
B. 在溶液中亚硫酸氢铵与等物质的量氢氧化钠混合:
NH4++HSO3-+2OH-==SO32-+NH3↑+2H2O
C. 氯气通入冷的烧碱溶液中:2Cl2+2OH-==3Cl-+ClO-+H2O
D. 硫酸氢钠溶液中加入碳酸氢钠溶液:H++HCO3-==CO2↑+H2O
(BD )16. 下列离子方程式书写正确的是
A. 在碘化亚铁溶液中通入足量氯气:2Fe2++2I-+2Cl2==2Fe3++I2+4Cl-
―13―
B. 用铂电极电解氯化钠饱和溶液:2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C. 向硫酸亚铁溶液中通入H2S气体:Fe2++H2S==FeS↓+2H+
D. 氯化铵溶于水:NH4++2H2O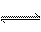 H3O++NH3?H2O
H3O++NH3?H2O
(AC)17. 下列反应的离子方程式正确的是
A. 硫酸亚铁酸性溶液中加入过氧化氢:4Fe2++2H2O2+4H+==4Fe3++4H2O
B. 氯化铝溶液通入过量氨水:Al3++4OH-==AlO2-+2H2O
C. 碳酸钙溶于醋酸:CaCO3+2CH3COOH==Ca2++2CH3COO-+H2O+CO2↑
D. 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2==CaCO3↓+2HClO
(AC)18. 下列离子方程式写正确的是
A. 过量二氧化碳通入偏铝酸钠溶液中:CO2+AlO2-+2H2O==Al(OH)3↓+HCO3-
B. 用湿润的醋酸铅试纸检验硫化氢气:H2S+Pb2+==PbS↓+2H+
C. 氯化铵溶于水:NH4++2H2O NH3?H2O+H3O+
NH3?H2O+H3O+
D. 用烧碱溶液吸收尾气中少量二氧化硫:OH-+SO2==HSO3-
(BC )19. 下列离子方程式正确的是
A. 漂白粉溶于盐酸:Ca(ClO)2+2H+==Ca2++2HClO
B. 磷酸二钠溶液中加入足量的氢氧化钡溶液:
2H2PO4-+3Ba2+=4OH-==Ba3(PO4)2↓+4H2O
C. 铝溶于氢氧化钠溶液中:2Al+2OH-+2H2O==2AlO2-+3H2↑
D. 饱和氯化铁溶液滴加沸水中:Fe3++3H2O==Fe(OH)3↓+3H+
( B )20. 下列离子方程式书写正确的是
A. 向NaHSO4溶液中滴加Ba(OH)2溶液显中性:H++SO42-+Ba2++OH-==BaSO4↓+H2O
B. 向NaAlO2溶液中加盐酸至呈酸性:AlO2-+4H+==Al3++2H2O
C. 碳酸氢铵溶液中加入过量NaOH:HCO3-+OH-==CO32-+H2O
 D. 向苯酚钠溶液中通入过量CO2:2
D. 向苯酚钠溶液中通入过量CO2:2 -O-+CO2+H2O―→2 -OH+CO32-
-O-+CO2+H2O―→2 -OH+CO32-
(A )21. 下列离子方程式正确的是
A. NaHS水解反应:HS-+H2O H2S+OH-
H2S+OH-
B. 石灰石溶于醋酸:CaCO3+2H+==Ca2++CO2↑+H2O
C. Al投入FeCl2溶液中:Al+Fe2+==Al3++Fe
D. 往Ba(OH)2溶液中滴入H2SO4溶液:Ba2++SO42-==BaSO4↓
( C)22. 下列离子方程式中正确的是 ( )
A. 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全
|