
2008年北京市高级中等学校招生考试
化学试卷
可能用到的相对原子质量
H
部分碱和盐和溶解性表(
阳离子
阴离子







溶
微
不
不
不
不

不
不
微
不
不
不
第Ⅰ卷 (机读卷 共30分)
一、选择题(每小题只有一个选项符合题意。共30个小题,每小题1分,共30分。)
1.地壳中含量最多的元素是
A.氧 B.硅 C.铝 D.铁
2.天然气是重要的化石燃料,其主要成分是
A.氧气 B.氮气 C.氢气 D.甲烷
3.下列过程中,属于化学变化的是

A.蜡烛燃烧 B.冰雪融化 C.菠萝榨汁 D.透水砖渗水
4.下列物质中,属于氧化物的是
A. NaCl B. MnO
5.下列金属中,金属活动性最强的是
A. Zn B. Mg C. Fe D. Cu
6.下列物质中,含有氧分子的是
A. O2 B. H2O C. CO2 D. SO2
7.为防止骨质疏松,应补充的元素是
A. 铁 B. 锌 C. 钙 D. 碳
8.决定元素种类的是
A.质子数 B.中子数 C.电子数 D.最外层电子数
9.在日常生活中,不作调味品的物质是
A.食盐 B.蔗糖 C.白醋 D.自来水
10.下列物质中,属于纯净物的是

11.古人曾有赞美菊花的诗句“冲天香阵透长安”。浓郁的花香遍布长安的原因是
A.分子的质量很小 B.分子间有间隔
C.分子在不断运动 D.分子由原子构成
12.下列二氧化碳的用途中,不正确的是
A.供给呼吸 B.用作气体肥料 C.用于灭火 D.生产碳酸饮料
13.下列物质中,不需密封保存的是
A.浓硫酸 B.氢氧化钠 C.大理石 D.澄清石灰水
14.汽车安全气囊内的物质能在碰撞后 内迅速反应,生成一种空气中含量最多的气体,该气体是

A. 氧气 B. 二氧化碳 C. 氮气 D. 稀有气体
15.下列化学方程式书写正确的是
A.
B.
C.
 D.
D. 
16.农作物缺钾时,抗病虫害和抗倒伏能力降低,此时应该施用的化肥是
A. B.
B.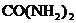 C.
C.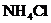 D.
D.
17.北京是极度缺水的城市。作为北京市民,下列生活习惯应该摒弃的是
A.用盆接水洗菜 B.用养鱼水浇花草
C.使用节水龙头 D.丢弃未喝完的矿泉水瓶
18.下列实验基本操作中,正确的是
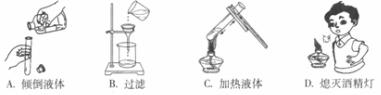
19.下列物质的性质中,属于化学性质的是
A.铅具有导电性 B.碳酸氢钠能与稀盐酸反应
C.氯化钠是白色固体 D.常温下甲烷是无色无味气体
20.下列是一些物质的,酸碱性最接近中性的是
A.苹果汁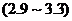 B.蕃茄汁
B.蕃茄汁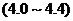
C.玉米粥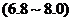 D.肥皂水
D.肥皂水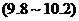
21.除去CO中混有的少量的方法是
A.通入浓硫酸 B.通入氢氧化钠溶液
C.点燃混合气体 D.通过灼热的氧化铁
22.下图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号。下列说法中,不正确的是
A.实验时红磷一定过量
B.点燃红磷前先用弹簧夹夹紧乳胶管
C.红磷熄灭后立刻打开弹簧夹
D.最终进入瓶中水的体积约为氧气的体积
23.下列实际应用中,利用中和反应原理的是
①用生石灰作食品干燥剂 ②用熟石灰和硫酸铜配制波尔多液
③施用熟石灰改良酸性土壤 ④用氢氧化钠溶液处理泄漏的浓硫酸
A.①② B.③④ C.①④ D.②③
24.下图为某有机物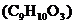 的分子模型,该有机物是一种高效食品防腐剂。下列说法中,不正确的是
的分子模型,该有机物是一种高效食品防腐剂。下列说法中,不正确的是
A.该有机物由3种元素组成
B.该有机物能减缓食品变质
C.该有机物分子中碳、氧原子的个数比为3:1
D.该有机物中含氧元素的质量分数最小
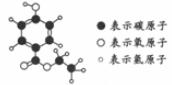
25.“三效催化转换器”可将汽车尾气中有毒气体处理为无毒气体。下图为该反应的微观示意图,其中不同的球代表不同种原子。下列说法中,不正确的是
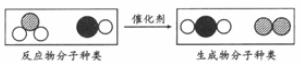
A.分子在化学变化中可分 B.此反应一定有单质生成
C.原子在化学变化中不可分 D.参加反应的两种分子的个数比为1:1
26.下列连线前后关系不正确的是
A.限制使用塑料袋――减少污染 B.杜绝非法开采矿山――保护资源
C.开采海底石油――开发新能源 D.研制自清洁玻璃――研究新材料
27.为比较4种金属X、Y、Z、W的金属活动性,小刚进行了一系列实验,结果如下表所示。其中能反应的记为“√”,不能反应的记为“-”,无标记的表示未做该实验。
参加反应的物质
X
Y
Z
W
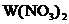 溶液
溶液
-
√
-
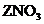 溶液
溶液
√
√
√
稀盐酸
-
√
-
√
则它们的金属活动性顺序为
A. B.
B.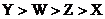
C. D.
D.
28. 新型纳米材料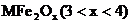 中M表示
中M表示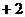 价的金属元素,在反应中化合价不发生变化。常温下,
价的金属元素,在反应中化合价不发生变化。常温下,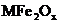 能使工业废气中的
能使工业废气中的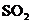 转化为S,转化流程如下图所示:
转化为S,转化流程如下图所示:

已知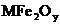 中Fe为
中Fe为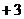 价,下列说法中,不正确的是
价,下列说法中,不正确的是
A.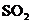 是大气污染物 B.
是大气污染物 B.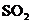 不是该反应的催化剂
不是该反应的催化剂
C.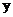 的数值为4 D.
的数值为4 D.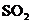 发生了分解反应
发生了分解反应
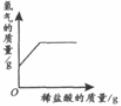
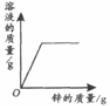
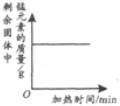
29.下列4个坐标图分别表示4个实验过程中某些质量的变化,其中正确的是
A
B
C
D
向一定量铁粉中滴加稀盐酸
向一定量硫酸铜溶液中不断加入锌粉
加热一定量高锰酸钾固体
向一定量氢氧化钠溶液中滴加稀盐酸

30.某粗盐样品中含有可溶性的氯化镁、氯化钙杂质和不溶性的泥沙。常温下,将140g该粗盐样品溶解于水中,过滤得到不足3g泥沙和1000g溶液。取出500g溶液进行测定,其中含有镁元素1.2g,钙元素2g,氯元素42.6g。则原粗盐中氯化钠的质量分数约为
A. B.
B.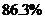 C.
C.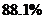 D.
D.
第Ⅱ卷 (非机读卷 共50分)
二、填空题(共5小题,每空1分,共26分。)
31.(5分)2008年8月8日,第29届奥运会在北京举行。
(1)北京奥运场馆倍受世人瞩目。下列介绍的材料中,属于有机合成材料的是________(填字母,下同)。

(2) 北京奥运会期间供应的重点菜肴之一是北京烤鸭。食用烤鸭时配以薄饼、大葱、甜面酱和黄瓜等,营养丰富,其中含有的营养素有油脂、糖类、___________、水、维生素和无机盐等。
(3)北京奥运村的生活热水都由太阳能热水利用系统提供。下列有关太阳能的说法中,正确的是____________________。

A. 取之不尽 B. 是化石燃料 C. 是无污染能源 D. 可转变为热能、电能
(4)北京奥运祥云火炬上端的外壁有430个通气孔。这些孔不仅能把燃烧的废气排出去,还能_____________________,以保证燃料的充分燃烧。
(5)北京奥运“蓝天计划”重在改善北京的空气质量。市政府采取的有效措施之一是冬季用燃烧天然气代替燃煤取暖,该项措施的作用是 ________。
32.(4分)下列数据是硝酸钾固体在不同温度时的溶解度。
温度/℃
0
20
40
60
80
溶解度/g
13.3
31.6
63.9
110
169
(1)硝酸钾溶液中的溶剂是__________。
(2)20℃时,向 水中加入 硝酸钾,充分溶解后得到__________(填“饱和”或“不饱和”)溶液。
(3)20℃时,向 水中加入 硝酸钾,若使硝酸钾完全溶解,可以采用的方法是_____________。
(4)如图所示,小烧杯中盛放的是上述(2)中所得的硝酸钾溶液。若将少量的下列物质分别小心地加入到大烧杯的水中,不断搅拌,一定能够使小烧杯中有固体析出的是___________(填字母)。

A.冰 B.浓硫酸 C.硝酸铵 D.干冰 E.氢氧化钠 F.氧化钙
33.(6分)钢铁是重要的金属材料。
(1)下列铁制品的用途中,利用金属导热性的是______________(填字母,下同)。

(2)目前世界上已有50%以上的废钢铁得到回收利用,其目的是___________。
A. 节约金属资源 B. 合理开采矿物 C. 防止钢铁生锈
(3)为防止水龙头生锈,其表面镀有一层铬。铁生锈的条件是______________。
(4)将生锈的铁制品放入盛有过量稀盐酸的洗槽中,观察到溶液变黄,有无色气泡逸出。
①写出发生反应的化学方程式 _____________________________________________
____________________________________。
②氯化铁溶液可以作净水剂。欲将上述所得溶液中含铁的物质以氯化铁形式回收,加入过氧化氢溶液反应可生成氯化铁和水。已知每生成162.5g的氯化铁,就同时生成18g的水。则该反应的反应物的化学式为________________________________________。
34.(5分)消毒剂在公共场所进行卫生防疫时发挥着重要的作用。
(1)氢氧化钠能杀灭细菌、病毒和寄生虫卵等,它的俗名为______________。
(2)二氧化氯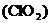 可用于饮用水的杀菌消毒,其中氯元素的化合价为________。
可用于饮用水的杀菌消毒,其中氯元素的化合价为________。
(3)氧化钙与水反应后生成一种具有消毒能力的物质,该物质的化学式为________。
(4)过氧乙酸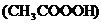 是被广泛使用的高效消毒剂,它不稳定易分解放出一种常见的气体单质,并生成醋酸
是被广泛使用的高效消毒剂,它不稳定易分解放出一种常见的气体单质,并生成醋酸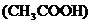 ,该反应的化学方程式为__________________
,该反应的化学方程式为__________________
______________________________________;若一瓶久置的过氧乙酸溶液已完全分解,所得溶液中醋酸的质量分数为12%,则原溶液中过氧乙酸的质量分数为______________%(结果保留一位小数)。
35.(6分)A~G是初中化学常见的7种物质,其中至少有一种物质是无色气体,且A与G含有相同的金属元素。它们在一定条件下转化关系如下图所示,其中部分反应物或生成物已略去。
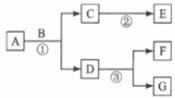
请针对以下两种情况回答问题。
(1)若A中两种元素的质量比为 ,F是一种红色金属,则F的化学式为________;写出反应①、③的化学方程式:
①_____________________________________________;
③_____________________________________________。
(2)若F与C常温下可以反应,②、③属于同一种基本反应类型,则A的化学式为______;写出反应①的化学方程式_________________________________________;反应②的基本反应类型是______________。
三、实验题(共3小题,每空1分,共18分。)
36.(6分)根据下图所示水、二氧化碳和氧气的性质实验,请回答以下问题。
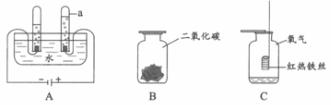
(1)仪器a的名称是_________________________。A装置中发生反应的化学方程式为_____
_____________________________________。用带火星的木条检验a中的气体,观察到木条复燃,该气体是__________。
(2)将白色纸花用紫色石蕊试液喷湿,放入集气瓶B中,观察到的现象是___________。
(3)集气瓶C中的现象:铁丝在氧气中剧烈燃烧,_______________,放出大量的热,有黑色固体生成。该反应的化学方程式为_____________________________。
37.(4分)老师用下图所示装置为同学们做了一个兴趣实验。A装置中盛有二氧化锰黑色粉末,B装置中盛有足量的澄清石灰水,C装置中盛有足量的稀盐酸,气球中装有少量的碳酸钠粉末。
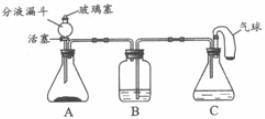
(1)打开分液漏斗的活塞和玻璃塞,使A装置与大气相通,将气球中的碳酸钠粉末全部倒入稀盐酸中,可以观察到C装置中的现象是_______________________________________。
(2)待上述反应结束后,从分液漏斗注入足量的过氧化氢溶液,关闭活塞和玻璃塞,A装置中发生反应的化学方程式为___________________________________________。
(3)在整个实验过程中,B装置中的现象是______________________________。
(4)C装置中气球的作用是___________(填字母)。
a. 收集纯净气体 b. 添加固体药品
c. 调节C装置容积 d. 控制气体总量
38.(8分)实验盒中有7种没有标签的溶液,老师让化学实验小组同学鉴别这些溶液。

(1)调查研究:
①实验盒中记录单上登记的7种溶液是: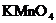 、
、 、
、 、
、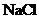 、
、 、
、 和稀盐酸,其中有颜色的是________
溶液。
和稀盐酸,其中有颜色的是________
溶液。
②查阅资料:无色有刺激性气味的氯化氢气体溶于水得到盐酸。
③研究方式:从5种无色溶液中任意取出4种为一组进行鉴别。这样的组合共有______组。
(2)提出假设:同学们从5种无色溶液中取出4种,贴上A、B、C、D标签,并且假设这一组溶液可能是 、
、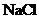 、
、 和稀盐酸。
和稀盐酸。
(3)实验探究:同学们按以下步骤进行鉴别。
第一步:取4支试管,分别加入少量的A、B、C、D溶液,然后依次加入少量盐酸,实验现象记录如下:
溶液
A
B
C
D
加入盐酸后的现象
无明显变化
无明显变化
有气泡产生
无明显变化
实验结论:C是_______________溶液。
第二步:依据下图装置进行实验,其中夹持固定装置已略去。从长颈漏斗加入盐酸,可以观察到C溶液中有气泡产生,A溶液中有白色沉淀生成,B、D溶液均无明显变化。
实验解释:A溶液中发生反应的化学方程式为_______________________。

第三步:依据下图装置进行2个实验。取少量B溶液倒入蒸发皿,加热,闻到有刺激性气味,停止加热。再取少量D溶液倒入另一蒸发皿,加热,有白色固体析出,停止加热。
实验结论:B是稀盐酸,D是NaCl溶液。

经过上述三步实验,同学们认为第5种无色溶液是NaOH溶液。
(4)实验反思:老师引导同学们讨论了上述实验探究过程。进行了全面反思。
①老师指出:实验结论仍有不确定性。不能确定的是______________溶液;其鉴别方法是__________________________________________________________________________
②老师提示:鉴别出C溶液后,不需外加试剂,就可以简便地鉴别出A、B溶液。请完成下列实验报告。
实验步骤
实验现象和结论
四、计算题(共2小题,共6分。)
39.(3分)CO是大气污染物之一。用氯化钯 可以测定微量CO的存在,该反应的化学方程式为
可以测定微量CO的存在,该反应的化学方程式为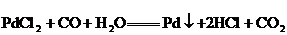 。若反应后得到Pd的质量为1.06g,则测得CO的质量为多少克?(已知Pd的相对原子质量为106)
。若反应后得到Pd的质量为1.06g,则测得CO的质量为多少克?(已知Pd的相对原子质量为106)
40.(3分)有一种石灰石样品的成分是CaCO3和SiO2 。课外小组同学将100g盐酸分5次加入到35g石灰石样品中(已知SiO2不与盐酸反应),得到如下部分数据和图象。
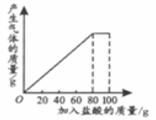
次数
第1次
第2次
第3次
加入盐酸的质量/g
20
20
20
剩余固体的质量/g
30
a
20
请计算:
(1)第2次加入盐酸后,a为________________g。
(2)石灰石样品中钙元素、碳元素和氧元素的质量比为多少?(结果用最简整数比表示)(3)10%的CaCl2溶液可作路面保湿剂。欲将第5次实验后的溶液配成10%的CaCl2溶液,可先向此溶液中加入足量的石灰石粉末,完全反应后过滤,这时还需要向滤液中加入水多少克?(假设实验过程中溶液损失忽略不计)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com