
2009年广东省中考模拟考试
化学试卷(八)
说明:本试题满分100分,考试时间80分钟。
选用的相对原子质量:
H:
第一卷
一、选择题(本大题14小题,每小题2分,共28分。在每小题列出的四个选项中,只有一个是正确的)
1.下列生活中的常见现象,一定涉及化学变化的是
A.放在衣柜里的樟脑球逐渐变小
B.冰箱中放入木炭后,异味消失
C.自行车被雨淋一段时间后,出现锈渍
D.夏天带到学校的咸菜表面有时出现食盐
2.以下生活常识的认识正确的是
A.绿颜色的食品均为“绿色食品” B.油污可被洗涤剂通过乳化作用除去
C.白色物质造成的污染即为“白色污染” D.新鲜牛奶中不含任何化学物质
3.我市是全国“节能减排”的排头兵,以下符合我市“节能减排”理念或做法的是
A.积极推广使用含铅汽油 B.禁止开发和利用地热能
C.夏天使用空调时,温度不低于26℃ D.禁止使用煤、石油、天然气等能源
4.“垃圾是放错了位置的资源”,应分类回收。生活中废弃的塑胶鞋、废轮胎等可归为一类加以回收,因为它们都属于
A.有机物 B.氧化物 C.盐 D.金属或合金
5.下列各图是初中化学的几个实验操作,其中不正确的是

A.熄灭酒精灯 B.检查装置的气密性
C.取用粉末状药品 D.给液体物质加热
6.某饮品的主要成分为脂肪、鸡蛋蛋白粉、钾、钙等。该饮品不能为人体补充的营养素是
A.无机盐 B.油脂 C.蛋白质 D.维生素
7.“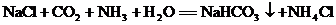 ”是著名的“侯氏制碱法”的重要反应之一。以下对该反应的见解正确的是
”是著名的“侯氏制碱法”的重要反应之一。以下对该反应的见解正确的是
A.该反应为化合反应 B.NaHCO3不属于盐
C.反应物中只有一种氧化物 D.该反应可获得氮肥
8.为预防手足口病,可用84消毒液(主要成分是NaClO)对生活用品消毒,用酒精是不管用的。有关NaClO的说法错误的是
A.NaClO由三种元素组成
B.NaClO是一种钠盐
C.NaClO中氯元素的化合价为-1价
D.NaClO中Na、Cl、O的原子个数比为1┱1┱1
9.以下各组所选的鉴别试剂,正确的是
被鉴别的物质
鉴别的试剂
A
Al和Mg
Na2SO4溶液
B
稀HCl和稀H2SO4
Fe
C
K2SO4溶液和CaCl2溶液
(NH4)2CO3溶液
D
Na2CO3溶液和NaOH溶液
酚酞试液
10.物质M(用□表示)和物质N(用○表示)的反应微粒之间的关系如下图所示,该反应的化学方程式表示正确的是

A.
C.
11.以下对实验现象的分析合理的是
①向某无色溶液中滴入紫色石蕊试液,溶液变蓝色,证明该溶液呈碱性
②向某无色溶液中滴入氯化钡溶液,产生白色沉淀,证明该溶液是硫酸溶液
③某白色固体与熟石灰混合后加热,产生可使湿润的pH试纸变蓝色的气体,证明该固体是铵盐
④把燃着的木条伸入某无色气体的集气瓶中,火焰熄灭,证明该气体是二氧化碳
A.①③ B.③④ C.①④ D.①②③④
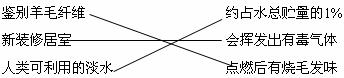
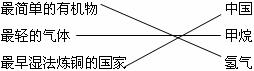
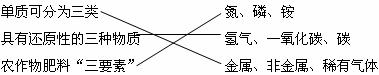
12.下列对某一主题知识归纳全部正确的是
A.性质与用途

B.生活常识
C.化学之最
D.初中化学的“三”
13.A、B、C三只小烧杯内分别依次盛有一定体积的浓氨水、酚酞溶液、酚酞溶液,按下图 所示进行探究活动,不能得到的结论是
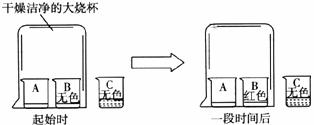
A.氨水能使酚酞溶液变红 B.碱能使酚酞溶液变红
C.空气不能使酚酞溶液变红 D.浓氨水易挥发,氨气易溶于水
14.向下表的甲物质中逐滴加入相应的乙溶液至过量,反应过程中生成气体或沉淀的质量与加入乙的质量关系,能用下图曲线表示的是
序号
甲
乙
①
HNO3和Mg(NO3)2的混合溶液
KOH溶液
②
Ag―Zn合金
稀H2SO4
③
久置空气中的铝片
稀盐酸
④
含有Na2CO3的NaOH溶液
稀HNO3
⑤
HCl和H2SO4的混合酸
Ba(NO3)2溶液

A.②⑤ B.①③④ C.①②④ D.①③⑤
第二卷
二、填空题(本大题5小题,共20分)
15.(4分)下图标出的是有关灯泡组成的物质,请根据下图回答下列问题:

(1)所标物质中属于金属材料的是__________,属于非金属单质的是__________。(各写一种即可)
(2)物质的性质决定其用途,请你就图中标出的物质举一例说明:________________。
(3)比较锡和铜的金属活动性强弱可采用______________________________的方法。
16.(5分)某化肥包装袋上的部分说明如下图所示。
硝酸铵
化学式 NH4NO3
净重
含氮量 ≥30%
注意事项 密封贮存、防潮防晒、隔绝热源……
(1)硝酸铵属化学肥料中的__________(填序号)。
A.钾肥 B.氮肥 C.磷肥
(2)硝酸铵应具有的性质是__________(填序号)。
A.易溶于水 B.有挥发性 C.受热易分解
(3)硝酸铵能与强碱反应,其中与烧碱反应的方程式为: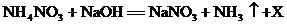 ,则X的化学式是:__________;施用该类肥料时,要避免与__________(填“酸”或“碱”)性物质混用,否则会降低肥效。
,则X的化学式是:__________;施用该类肥料时,要避免与__________(填“酸”或“碱”)性物质混用,否则会降低肥效。
17.(4分)下表是部分元素的原子结构示意图、主要化合价等信息,请完成以下填空:
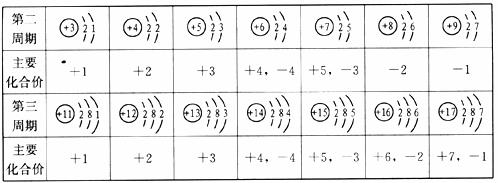
(1)铝原子的最外层电子数是__________。
(2)核电荷数为12的元素符号是__________。
(3)原子序数为8和14的元素组成化合物的化学式是__________。
(4)请你总结出此表中的原子结构与元素化合价或周期数的关系________(任写一条)。
18.(3分)下图是甲、乙两物质的溶解度曲线:
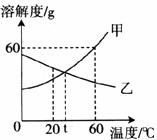
(1)甲、乙两物质溶解度相等时的温度为__________℃。
(2)
(3)
A.有乙物质的晶体析出 B.乙的溶解度不变
C.乙的溶质质量分数增大 D.乙溶液为不饱和溶液
19.(4分)2008年北京奥运火炬“祥云”的设计体现了“科技奥运”、“绿色奥运”的主题。
丙烷
丁烷
熔点(℃)
-189.7
-138.4
沸点(℃)
-42.1
-0.5
(1)丁烷曾被有些国家选为火炬燃料。由上表可知,在低温地区,丁烷会处于________(填“固态”、“液态”或“气态”),不利于点火燃烧,因此“祥云”采用丙烷为燃料。丙烷在空气中完全燃烧后的产物是CO2和H2O,对环境没有污染,则丙烷必定含有的两种元素是____________________。
(2)普通塑料制品难以自然降解,遗弃后容易造成“白色污染”,因此,“祥云”采用可回收重复利用的铝合金作为外壳材料。铝具有较强抗腐蚀性的原因___________________。
(3)“祥云”火炬上的“云纹”,具有浓郁的中国特色,主要是用酸等物质腐蚀雕刻形成的。若用稀盐酸来雕刻,则铝与稀盐酸反应的化学方程式为__________________________。
三、解答题(本大题2小题,共15分)
20.(6分)A~H都是初中化学中的常见物质,它们之间的转化关系如下图所示。A是天然气的主要成分,E是一种常见的食品干燥剂。请回答:

(1)A的化学式为__________。
(2)反应③的基本反应类型是__________。
(3)反应②的化学方程式为___________________,反应④的化学方程式为__________ ____________________。
21.(9分)某化工厂排出的废水透明、澄清、略显蓝色。一同学取少量废水,加入过量的盐酸,有不溶于稀硝酸的白色沉淀生成。过滤,所得的滤液分成两份,一份滤液中加入稀硫酸,也有不溶于稀硝酸的白色沉淀生成;另一份滤液中加入氢氧化钠溶液,产生蓝色溶液。试回答:
(1)用化学式回答:加入过量的盐酸,生成的白色沉淀是__________;生成的蓝色溶液是__________。
(2)废水中一定含有的物质是__________(填编号)。
A.氯化物 B.硫酸盐 C.硝酸盐 D.碳酸盐
(3)该同学设计了一个从废水中除去重金属离子的实验方案如下【已知白色的Fe(OH)2固体在潮湿的空气中可生成红褐色的Fe(OH)3】:
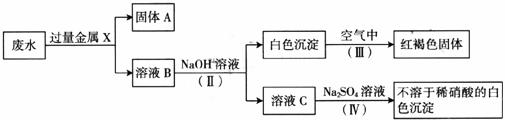
①金属X为__________,固体A中一定含有的物质为(写化学式)__________。
②B溶液中的溶质一定含有__________和__________(填序号字母)。
A.K2CO3 B.Fe(NO3)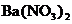
③第Ⅳ步反应的化学方程式为______________________________。
四、实验题(本大题2小题,共23分)
22.(13分)现有以下实验仪器,请按要求填空:
(1)仪器⑤的名称是__________;配制一定质量分数的氯化钠溶液,需用到的仪器有__________(填序号),还缺少的仪器是__________(填名称);如果用石灰石与盐酸反应制取CO2,可选上述仪器中的__________(填序号)组合成制气装置。
(2)某同学利用仪器①与⑥组合成一个贮气装置。当装满水用排水法收集甲烷(甲烷难溶于水、比空气轻)时,气体应从仪器①的__________(填“a”或“b”)通入;集满甲烷后将其导出使用时,水应该从仪器①的__________(填“a”或“b”)导入。该装置还有其他用途,请你任举一例:___________。
(3)下列对实验现象或实验操作的叙述正确的是__________(填序号,选错一个扣1分,本小题不出现负分)。
①铁丝在空气中燃烧产生黄色火焰;
②镁条在空气中燃烧发出耀眼的白光;
③将CO还原Fe2O3的尾气直接排入空气;
④不慎将氢氧化钠溶液沾在皮肤上,要用较多的水冲洗,再涂上稀硼酸溶液;
⑤加热高锰酸钾制备氧气、并用排水法收集满氧气后,先移出导管,后撤酒精灯。
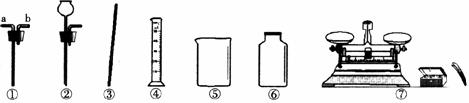
23.(10分)某研究性学习小组对“SO2能否与H2O反应生成酸”进行探究。请你参与他们的探究活动,并回答有关问题。
(1)查阅资料:①SO2常温下是一种无色气体,易溶于水;②酸能使蓝色石蕊试纸变成红色;③SO2有毒。
(2)提出假设:SO2能与H2O反应生成酸。
(3)实验探究:设计如上图所示装置进行实验。
①实验过程中,A装置内蓝色石蕊试纸的颜色始终没有变化。A装置的作用是___________。
②在通入SO2之前将B装置中胶头滴管内的蒸馏水滴到蓝色石蕊试纸上,未见试纸颜色发生变化,此步操作的目的是______________。当有SO2通过时发现湿润的蓝色石蕊试纸变红,此现象说明_____________,此过程中反应的化学方程式为________________________。
(4)结论:原假设成立。
(5)反思与评价:该实验方案中,有一个明显的疏漏,请你帮他们指出不足之处:________________________________________。
(6)拓展探究:该研究性学习小组取刚降到硫酸厂(生产过程中产生SO2)附近的雨水进行测定,每隔几分钟测一次pH,其数据如下表所示:
测定时刻
5:05
5:10
5:15
5:20
5:25
5:30
5:35
pH
4.95
4.94
4.94
4.88
4.86
4.85
4.85
分析上述数据的变化,你可得出的结论是______________________________;
针对此结论,你猜测其中的原因为____________________________________。
结合大理石雕像受到酸雨腐蚀的事实,你认为碳酸、硫酸、亚硫酸(H2SO3)酸性由强到弱的顺序是____________________。
五、计算题(本大题2小题,共14分)
24.(5分)农作物的无土栽培可以显著提高产品的产量和质量。某茄子的无土栽培营养液中含有7.08%的KNO3。
(1)KNO3属于__________(填“复合肥料”、“氮肥”、“钾肥”或“磷肥”)。其中氮、氧元素的质量比为__________。
(2)要配制150kg该营养液,需要KNO3的质量是__________kg。
25.(9分)钢铁工业是国家工业的基础。2007年我国粗钢产量接近5亿吨,居世界前列。某校兴趣小组取某种钢样进行试验,请计算:
(1)取钢样(假设只含铁单质和碳单质)粉末100g,在氧气中充分燃烧,得到CO2气体4.4g,此钢样粉末中碳的质量分数为__________(保留到0.1%)。
(2)分别向四份不同质量的钢样粉末中加入100g稀硫酸溶液,充分反应后,测得的实验数据如下表所示:
序数
质量
实验1
实验2
实验3
实验4
钢样粉末的质量
2.84g
4.25g
6.23g
7.51g
生成H2的质量
0.10g
0.15g
0.20g
0.20g
①硫酸溶液中溶质的质量是__________g。
②求在实验3中反应后溶液的溶质质量分数。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com