
2009年厦门市初中毕业及高中阶段各类学校招生考试
化学试卷
(试卷满分:100分;考试时间:90分钟)
可能用到的相对原子质量:
H一
一、选择题(本题l5小题,共30分,每小题只有一个选项符合题目要求,请在答题卡选择题栏内用2B铅笔将该选项的序号涂黑)
1.广泛用于制造日常生活用品,且地壳中含量最多的金属元素是
A.铝 B.镁 C.硅 D.铁
2.医生建议小明多吃蔬菜,则小明需要补充的营养素主要是
A.维生素 B.油脂 C.蛋白质 D.无机盐
3.下列做法易使金属被腐蚀的是
A.用过的菜刀擦干 B.铝锅盛放酸菜 C.铁护栏涂上油漆 D.自行车钢圈镀铬
4.根据下表判断,肉类变质过程中酸碱性的变化趋势是
名称
新鲜肉
次鲜肉
变质肉
pH
5.8~6.2
6.3~6.6
>6.7
A.酸性变弱 B.酸性变强 C.酸性不变 D.碱性变弱
5.我市在节能减排方面走在全国前列,下列做法不利于节能或减少二氧化碳排放的是
A.使用节能的LED路灯,以减少电能的消耗
B.发展BRT快速公交,以减少汽油的消耗
C.提高现有火电厂煤的利用率,增加单位质量煤的发电量
D.多建燃烧煤或天然气的火电厂,以保证电力的供应
6.科学家发现由C60制取的化合物M有抑制艾滋病毒的作用,下列叙述不正确的是
A.厦大化学家制得了C50,它与C60都是单质
B.某物质含有C50分子和C60分子,该物质是化合物
C.由C60制取化合物M的过程,发生了化学变化
D.C60在空气中燃烧生成二氧化碳的反应是化合反应
7.下列是我市要打造的百亿产业群项目,其中不属于化学研究范畴的是
A.化学纤维的合成与加工 B.钨的冶炼与加工
C.软件的开发与应用 D.橡胶的合成与加工
8.科学发展观要求在经济建设中保护生态环境,则下列做法错误的是
A.设计绿色化学工艺,使原料中的原子100%转移到产物中
B.将垃圾分类回收后用于发电,并将尾气无害化处理后排放
C.将污染较大的企业全部迁到无人海岛,以减少对城市的污染
D.提高工业污水和生活污水的处理标准,减少污染物排放总量
9.科学家用单个分子制成了“纳米车”(如图),它能在人工操纵下运输药物分子到病源处释放以杀死癌细胞。下列有关“纳米车”的说法正确的是

A.“纳米车”的研制成功说明分子要在人为外力作用下才能运动
B.“纳米车”分子不是由原子构成的
C.“纳米车”运输药物分子的过程是肉眼可以直接看见的
D.“纳米车”研制成功说明在一定条件下人可以控制分子运动
10.下列关于耐高温新型陶瓷――氮化硅(Si3N4)的叙述,正确的是
A.氮化硅中Si、N两种元素的质量比为4:3
B.氮化硅中氮元素的质量分数为60%
C.
D.氮化硅的相对分子质量为l44
11.下列化学实验操作,正确的是
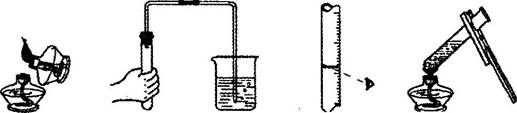
A.点燃酒精灯 B.检查气密性 C.读取液体体积 D.加热液体
12.根据图所示的实验现象,下列判断不正确的是
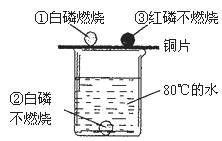
A.现象①②说明物质燃烧需要氧气
B.现象①说明白磷的着火点不高于
C.现象②③说明两种可燃物的着火点均高于
D.现象①③说明两种可燃物的着火点不同
13.下列实验方案错误的是
A.从海水中获得少量饮用水,可采用蒸馏的方法
B.从氯化钠溶液中获得氯化钠晶体,可采用直接过滤的方法
C.除去氯化钠溶液中的少量碳酸钠,可加入适量稀盐酸
D.检验某井水是否为硬水,可使用肥皂水
14.对下列课外实验活动的叙述,不正确的是
A.用小卵石、活性炭和细沙等物品可制作简易净水器
B.将明矾晶体悬挂在饱和明矾溶液中,晶体的形状可改变但质量不变
C.利用柠檬酸具有酸的性质,可在碳酸氢钠溶液中加入柠檬酸制汽水
D.将少量高锰酸钾晶体放入汽油中振荡,可形成紫红色的溶液
15.向烧杯中逐滴加入x溶液至过量(图1),生成沉淀或气体的质量与加入x溶液的质量关系符合图2的是


二、填空与简答(本题6小题,共35分)
16.(5分)我市正在逐步将管道煤气由石油液化气(主要成分是丁烷)改为天然气,小明家要进行灶具和燃气泄漏报警器的调整。请填空:
(1)丁烷燃烧的化学方程式为: 8CO2+10H2O
8CO2+10H2O
请写出天然气主要成分燃烧的化学方程式:________________________________________;
(2)若相同条件下,气体体积比等于分子数比。改为天然气后,同体积燃料燃烧消耗空气的体积将____________(填“增大”或“减小”),则灶具的调整方法是减小________(填“燃料”或“空气”)的进气量;
(3)燃气泄漏报警器的位置要从低于灶具的地方移到高于灶具的地方,其原因是_________。
17.(7分)下图是自然界碳循环简图,请回答

(I)含碳单质矿物燃烧的化学方程式为_________________________;
(2)海水吸收二氧化碳时,发生反应的化学方程式为_____________;
(3)植物光合作用时,二氧化碳和水在光的作用下生成葡萄糖
(C6H12O6)和氧气,其化学方程式为___________________________;
(4)人类降低空气中二氧化碳含量的研究有两个方向:一是减少二氧化碳的排放,另一是_____________________________________。
18.(6分)甲、乙、丙、丁是初中化学的常见物质,它们有下图的转化关系:

(1)若丙是最轻的气体,是公认的最清洁燃料,写出符合此转化关系的一个化学方程式:_________________________;
(2)若甲是极易与血红蛋白结合的有毒气体,乙是一种氧化物,丙是我国早在春秋战国时期就开始生产和使用的一种金属单质,写出符合此转化关系的一个化学方程式:
______________________________;
(3)若甲是由淀粉发酵而得的一种液态可再生能源,丙是能使澄清石灰水变浑浊的气体,写出符合此转化关系的一个化学方程式:___________________________。
19.(5分)在CuSO4和ZnSO4的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,没有气泡产生,则滤出的固体是________(填名称),滤液中一定含有的溶质为________、______ (填化学式),有关反应的化学方程式为__________________。
20.(6分)请按下图所示的硫酸知识网络填空(图中“―”表示相连的两种物质能发生反应,“→”表示一种物质能转化成另一种物质):

(1)写出两个属于复分解反应的化学方程式:
①__________________; ②_____________________;
(2)总结出酸的两条化学性质的反应规律:
①__________________; ②_____________________。
21.(6分)根据下图填空:
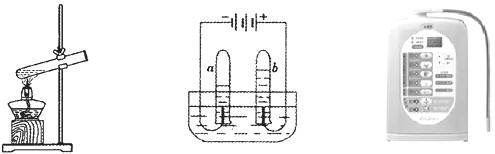
图1水蒸发实验 图2电解水实验 图3家用电解水器
(1)图2实验的化学方程式为___________________________________;
(2)比较图1和图2两个实验中水的变化,用分子原子的观点分析其不同点:
________________________________________________________________;
(3)在图2实验通电时,a试管中液体呈碱性、b试管中液体呈酸性,利用此原理设计的家用电解水器(图3),可得酸碱性不同的水,且各有其用途(见下表)。
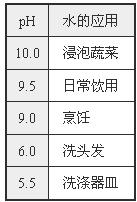
①上表中用于“日常饮用”的水遇紫色石蕊试液显_________色;
②家用电解水器生成的碱性水可除去水中有害的重金属离子,生成小分子团水,因而对健康有益。请用化学符号表示含5个水分子的水分子团:______________;
③图2装置电解实验完毕,测定剩余水的pH,结果与实验前相同。请对此现象可能的原因提出一个合理的猜想:____________________________________________________。
三、实验与探究(本题2小题,共l5分)
22.(7分)某兴趣小组要测定高锰酸钾样品的纯度(假设杂质受热不反应),请根据下列装置填空:
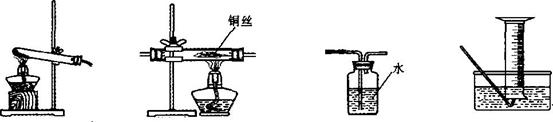
(1)组成D装置的两种主要玻璃仪器的名称是______________和____________;
(2)高锰酸钾样品在A装置中反应的化学方程式为______________________________;
(3)A装置试管口要略向下倾斜的原因是___________________________;
(4)要完成测定任务,需选用的装置有___________(填字母),需测量的数据有__________。
23.(8分)NaNO2是―种致癌物质。某兴趣小组为研究水中NaNO2的含量和消除污染的方法,进行了如下目视比色法实验(比较溶液颜色深浅以测定物质浓度的方法),请你参与实验,并填空:
(1)测定方法的研究
配制质量分数为0.07%的NaNO2标准溶液,分别取0、2、4、6、8、10 mL标准溶液于6支试管,加蒸馏水至总体积均为l0mL,分别加入约
①配制质量分数为0.07%的NaNO2溶液l000 mL,所需NaNO2的质量是_________g;
②用上述方法测定某水样,其与含2 mL标准溶液的色阶颜色相同,此水样中NaNO2的质量分数为___________;
(2)研究某水样在不同煮沸时间后NaNO2含量的变化
将另一水样用下图装置煮沸,测定不同煮沸时间NaNO2的质量分数,结果为:
煮沸时间(小时)
0
2
4
8
12
NaNO2的质量分数
0
0
0.014%
0.028%
0.056%
①兴趣小组设计的下图实验装置用到了蒸气回流装置,其作用是_______________;
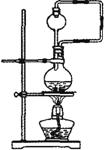
②根据上述数据,可见此水样随煮沸时问的延长NaNO2的质量分数会逐渐_________;
{3)寻找能降低水中NaNO2含量的物质,研究消除污染的有效方法
查阅资料可知,加入醋酸或双氧水可降低水中NaNO2的质量分数,请设计实验证明少量醋酸是否有降低水中NaNO2质量分数的作用,填写下列实验报告:
实验步骤
可能的实验现象
根据可能的实验现象得出的结论
四、信息与分析(本题l小题,共l0分)

材料二:l875年,法国化学家布瓦博德朗公布了他发现的新元素镓(元素符号为Ga)的性质:镓是银白色金属,密度
材料三:l876年,布瓦博德朗将金属镓提纯后测得镓的密度为

(1)镓元素的质子数为__________,其原子最外层电子数为_____________;
(2)请根据上述材料,总结金属镓的有关知识:
物理性质:_____________________________________________;
化学性质(请用化学方程式表示):_____________________________________;
用途:____________________________________;
(3)氢氧化镓与氢氧化钠都具有碱的性质,则氢氧化镓与稀硫酸反应生成盐的化学式为_____________;
(4)请从上述周期表片断中查出硅元素的一种数据,并指出其含义:_________________;
(5)上述材料中,化学家所使用的研究方法及其关系是____________________________。
五、计算与应用(本题l小题,共l0分)
25.小明购得用于食用菌种植的轻质碳酸钙,标签如下。为测定其含钙量小明进行的实验是:

①称取样品
②加入足量7.3%的盐酸充分反应,反应的化学方程式为:
CaCO3+2HCl=CaCl2+H2O+CO2↑
③将所生成的全部气体除杂干燥后,通入l
请计算,并回答下列有关问题:
(1)样品中碳酸钙的质量分数是多少?
(2)标签标示的含钙量是否正确,若不正确应如何改正?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com