|
试题详情
B.硫酸铵浓溶液与氢氧化钠浓溶液混和加热NH4+++OH―===NH3?H2O 试题详情
 C.明矾水解反应的离子方程式Al3++3H2O Al(OH)3+3H+ C.明矾水解反应的离子方程式Al3++3H2O Al(OH)3+3H+
试题详情
D.电解饱和食盐水时阴极电极反应式:2Cl―-2e―===cl2 试题详情
6.下列有关实验叙述正确的是 ( ) 试题详情
A.滴定管洗净后经蒸馏水润洗,即可注入标准液进行滴定 试题详情
B.物质的量浓度溶液配制时,一定要选择符合要求的容量瓶 试题详情
C.浓硝酸存放在带橡皮塞的棕色玻璃瓶中 试题详情
D.胶体粒子很小,可以穿过半透膜 试题详情
7.下列各组离子,在指定条件下能够大量共存的是 ( ) 试题详情
A.在AlCl3溶液中:Na+、CO32―、SO42―、NO3― 试题详情
B.pH=0的溶液中:Fe3+、Mg2+、Cl―、SO42― 试题详情
C.加入(NH4)2Fe(SO4)2?6H2O晶体的溶液中:Na+、H+、Cl―、NO3― 试题详情
D.水电离出c(H+)=1×10―10 mol?L―1的溶液中:K+、HCO3―、Cl―、S2― 试题详情
8.设NA为阿伏伽德罗常数,下列叙述中正确的是 ( ) 试题详情
A.标准状况下,22.4LCO2和O2混合气体中含有氧原子数约为2NA 试题详情
B.常温常压下,0.1mol Fe在0.1mol Cl2中充分燃烧,转移的电子说为0.3 NA 试题详情
C.2mol SO2和1mol O2在密闭容器中加热反应后,容器内物质的分子数为2 NA 试题详情
D.138g K2CO3晶体中的离子总数大于3 NA 试题详情
9.某合作学习小组讨论辨析以下说法,其中正确的组合是 ( ) 试题详情
① SiO2可以制光导纤维 ② 水玻璃和漂白粉都是混合物 试题详情
③ 不锈钢和目前流通的硬币都是合金 ④ 纯碱和熟石灰都是碱 试题详情
⑤ 豆浆和雾都是胶体 试题详情
A.①②③④ B.①②③⑤ C.②③⑤ D.①②⑤ 试题详情
10.在前一种分散系中慢慢滴加后一种试剂,能观察到先沉淀后变澄清的是 ( ) 试题详情
① 向氯化铝溶液中滴加氢氧化钠溶液 ② 向偏氯酸钠溶液中加盐酸 试题详情
③ 向氢氧化钠溶液中滴加氯化铝溶液 ④ 向氯化铝溶液中滴加氨水 试题详情
⑤ 向氢氧化铁胶体滴加硫酸溶液 试题详情
A.①②⑤ B.①②④⑤ C.②③④⑤ D.①③④⑤ 试题详情
试题详情
11.有浓度均为0.1 mol?L―1 ① 醋酸溶液 ② 氯化铵溶液 ③ 硫酸溶液各25mL。下列说法 试题详情
正确的是 ( ) 试题详情
A.三种溶液的pH大小的顺序是①>②>③ 试题详情
B.若三种溶液稀释相同倍数,pH值变化最大的是① 试题详情
C.三种溶液中由水电离出的氢离子浓度大小顺序为②>①>③ 试题详情
D.若分别加入25mL的氢氧化钠溶液,pH最大的是① 试题详情
试题详情
 12.反应2X(气)+Y(气) Z(气);△H<0,在不同温度(T1和T2)及压强(P1和 12.反应2X(气)+Y(气) Z(气);△H<0,在不同温度(T1和T2)及压强(P1和
试题详情
 P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示。下列判断正确的是 P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示。下列判断正确的是
试题详情
( ) 试题详情
A.T1<T2,P1<P2 试题详情
B.T1>T2,P1>P2 试题详情
C.T1<T2,P1>P2 试题详情
D.T1>T2,P1<P2 试题详情
试题详情
13.某同学欲完成2CHl2Ag====2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的 试题详情
 实验是 ( ) 实验是 ( )
试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
14.由一种阳离子与两种酸根离子组成的盐成为混盐。混盐CaOCl2在酸性条件下可以产生 试题详情
Cl2。下列关于混盐CaOCl2的判断不正确的是 ( ) 试题详情
A.该混盐与硫酸反应产生1mol Cl2时转移NA个电子 试题详情
B.该混盐的水溶液呈碱性 试题详情
C.该混盐具有较强的氧化性 试题详情
D.该混盐中的氯元素的化合价为-1 试题详情
15.右图为实验室制氢气的简易装置。若在加稀硫酸时,发现锌粒与稀硫酸没有接触而使反 试题详情
应不能进行,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是 ( ) 试题详情
 ① 食盐水 ② KNO3溶液 ① 食盐水 ② KNO3溶液
试题详情
③ 适量稀硫酸铜溶液 ④ Na2CO3溶液 试题详情
⑤ CCl4 ⑥ 浓氨水 试题详情
A.③⑤ B.②⑥ 试题详情
C.①③⑤ D.①②④ 试题详情
试题详情
16.铁和三氧化二铁的混合物共a mol,加入盐酸后固体全部溶解,共收集到b mol氢气,且向溶液中加入KSCN溶液不显红色,则原混合物中铁的物质的量为 ( ) 试题详情
A. B. B.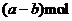 试题详情
C. D.b
mol D.b
mol 试题详情
17.短周期元素X、Y、Z和W的原子序数依次增大,且均为同周期,四元素原子的最外层 电子数之和为18,X和Y的原子序数比6:7,W原子最外电子层比次外层少一个电子, 下列说法不正确的是 ( ) A.Y的单质为原子晶体 B.X和W可形成离子化合物 C.Z和W的单质发生化学反应可生成两种共价化合物 D.Z和W最高价氧化物对应水化物都是强酸 试题详情
18.将一定质量的Mg和Al的混合物投入1 mol?L―1500mL稀硫酸中,固体全部溶解并产 生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入 试题详情
 NaOH溶液的体积关系如图所示。则下列说法正确的是 ( ) NaOH溶液的体积关系如图所示。则下列说法正确的是 ( )
A.Mg和Al的物质的量之比1:1 B.NaOH溶液的物质的量浓度为5 mol?L―1 试题详情
C.生成的H2在标准状况下的体积为11.2L D.Mg和Al和硫酸恰好完全反应 第Ⅱ卷(非选择题,共46分) 非选择题(本题包括6小 题,共46分) 试题详情
19.(6分)实验室为检测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为: 4CuI+Hg Cu2HgI4+2Cu(化合物中Hg为+2价) (1)上述反应产物Cu2HgI4中,Cu元素是
价。 (2)以上反应中的氧化剂为
,当有1mol CuI参与反应时,转移电子
mol。 (3)CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式: 试题详情
|
试题详情
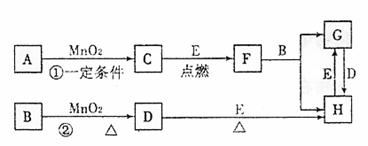
请回答下列问题:
(1)若反应①是在加热条件下进行的,则A是(填化学式)
;若反应①是在常温条件下进行的,则A是(填化学式)
;若在上述两种条件下得到等量的C单质,反应中转移的电子数之比为
。 (2)写出②的离子反应方程式:
。
(3)H用途广泛,如用作催化剂,印刷电路腐蚀剂和外伤止血济及净水等。若将Cu棒与碳棒用导线连接并插入H溶液中,可形成原电池,其中正极电极反应方程式为: 。 (4)写出G与D反应生成H的化学方程式为:
。
试题详情
21.(8分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合后所得溶液的pH如下表: 实验编号 HA的浓度/(mol?L-1) NaOH的浓度/(mol?L-1) 混合溶液的pH 甲 试题详情
试题详情
试题详情
试题详情
试题详情
0.1 pH>1 请回答:
(1)不考虑其他组的实验结果,仅从甲组情况分析,如何用a的大小来说明HA是强酸还是弱酸
。 试题详情
(2)不考虑其他组的实验结果,仅从乙组情况分析,c是否一定等于0.2 (填“是”或“否”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系是 (填序号)。 A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是 酸(填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是
。 试题详情
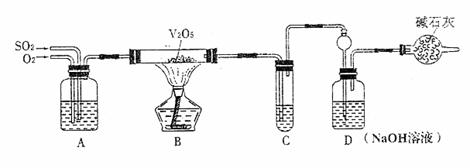
请回答下列问题:
试题详情
(1)已知0.5 molSO2被O2氧化成气态SO3,放出49.15kJ热量,反应的热化学方程式为
。 (2)实验时A中氧气导管冒出的气泡与二氧化硫导管冒出的气泡速率相近,其目的是 ;装置C中浓硫酸的作用为
。
(3)停止通入SO2,熄灭酒精后,为使残留在装置中的SO2、SO3被充分吸收,操作方法是
。
(4)实验结束后,稀释装置C中的溶液,并向其中加入足量的BaCl2溶液,得到的沉淀质量为ωg。若装置D增加的质量为a g,则此条件下二氧化硫的转化率是
(用含字母的代数表示,结果可不化简)。 试题详情
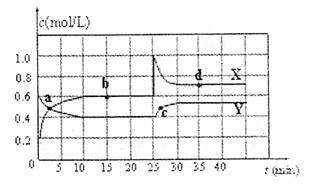
下列问题:
(1)图象中的平衡点是:
(用a、b、c、d填空)。
(2)图中的两条曲线,
是表示N2O4浓度随时间的变化曲线(填“X”或“Y”)。
(3)前10
min内用υ(NO2)表示的化学反速率为
。
(4)25
min时,导致平衡移动的原因是
。
试题详情
24.(7分)下表的实线表示元素周期表的部分边界,①―⑥分别表示元素周期表中对应位置的元素。 ① ② ③ ④ ⑤ ⑥ |
(1)在上表中用实线补全元素周期表边界
(2)元素②的氢化物电子式为:
。
(3)元素④的氢化物在CCl4中溶解度比在水中的溶解度
(填“大”或“小”)。
(4)元素⑤的单质,元素⑥的单质和⑤⑥形成的合金,这三种物质中,熔点最低的是
。 A.元素⑤的单质 B.元素⑥的单质 C.⑤⑥形成的合金 D.无法判断
(5)由元素①的最简单的氢化物,元素③的单质和KOH溶液组成的新型燃料电池中,负极上发生的反应的电极反应式为: 。
试题详情
1―5CDBCC 6―10BBABA 11―15CBCDC 16―18ADB 19.(6分)(1)+1(1分) (2)CuI (1分)
0.5(2分)
(3)2、5、2、1(2分) 20.(9分)
△
(2)MnO2+4H++2Cl- Cl2+Mn2++2H2O(1分)
(3)Fe3++e- Fe2+ (2分) (4)2FeCl2+Cl2 2FeCl3(2分) 21.(8分)(1)a=7时,HA是强酸 (1分)
a>7时,HA是弱酸(1分)
(2)否(1分)
C(2分)
(3)弱(1分)
c(Na+)>c(A-)>c(OH-)>c(H+) (2分)  22.(8分)(1)SO2(g)+ 22.(8分)(1)SO2(g)+ O2(g) SO3(g);△H=-98.3kJ?mol-1(2分) O2(g) SO3(g);△H=-98.3kJ?mol-1(2分)
(2)提高二氧化硫的转化率(1分) 吸收SO3(1分)
(3)继续通入氧气一段时间(2分)
(4) (2分) (2分) 23.(8分)(1)b d(各1分,共2分)
(2)Y (2分)
(3)0.04mol?L-1?min-1 (2分)
(4)增大NO2的浓度(2分) 24.(7分)(1) ① ② ③ ④ ⑤ ⑥
|
(2分)
(2)
(1分) (3)小(1分) (4)C(1分)
(5)CH4-8e-+10OH- CO32-+7H2O(2分)
| | | | | | | | | | | 












 1.意大利科学家获得了极具有理论研究意义的N4分子,N4分子结构如图所示。下列说法正
1.意大利科学家获得了极具有理论研究意义的N4分子,N4分子结构如图所示。下列说法正
















 4.在反应:
4.在反应:


