
题目列表(包括答案和解析)
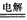 KIO3+3H2↑,则此反应中氧化剂为________________,还原剂为_________________。
KIO3+3H2↑,则此反应中氧化剂为________________,还原剂为_________________。现代生活中,人们越来越重视对微量元素的平衡摄入量。幼儿缺碘元素,会造成痴呆、发育不良;成人缺碘会患地方性甲状腺肿大。为控制该病的发生,有效的方法是食用加碘食盐。我国卫生部规定每千克食盐中应含有20~50 mg的碘元素。
(1)碘是合成________的主要原料之一。
A.胰岛素
B.甲状腺激素
C.生长激素
(2)加碘食盐包装袋上通常印有如下建议:“菜未熟不宜加入碘盐”。请简述其中所包含的化学原理
________________________________________________________________________
________________________________________________________________________。
(3)已知KIO3可用电解方法制得。其原理是:以石墨为阳极,以不锈钢为阴极,在一定电流强度和温度下电解KI溶液。总反应方程式为KI+3H2O KIO3+3H2↑,则此反应中氧化剂为__________,还原剂为__________。
KIO3+3H2↑,则此反应中氧化剂为__________,还原剂为__________。
(1)碘是合成下列哪种激素的主要原料之一( )
A.胰岛素 B.甲状腺激素 C.生长激素 D.雄性激素
(2)可用盐酸酸化的碘化钾和淀粉检验食盐中的碘酸钾。反应的化学方程式是____________________________。氧化产物与还原产物的物质的量之比为_____________,能观察到的明显现象是____________________________________________________。
(3)已知KIO3可用电解方法制得。原理是:以石墨为阳极,以不锈钢为阴极,在一定电流强度和温度下电解KI溶液。总反应方程式为KI+3H2O![]() KIO3+3H2↑,则两极反应式分别为阳极_________________,阴极为_________________________。
KIO3+3H2↑,则两极反应式分别为阳极_________________,阴极为_________________________。
(4)在某温度下,若以
 KIO3+3H2↑,则两极反应式分别为阳极___,阴极____。
KIO3+3H2↑,则两极反应式分别为阳极___,阴极____。碘缺乏症遍及全球,多发于山区,南美的安第斯山区、欧洲的阿尔卑斯山区和亚洲的喜马拉雅山区是高发病地区。我国云南、河南等10余省的山区发病率也较高。据估计我国患者大约有100万人左右。为控制该病的发生,较为有效的方法是食用含碘食盐,我国政府以国家标准的方式规定在食盐中添加碘酸钾(KIO3)。据此回答下列问题:
(1)碘是合成下列哪种激素的主要原料之一( )
A.胰岛素 B.甲状腺激素 C.生长激素 D.雄性激素
(2)长期生活在缺碘山区,又得不到碘盐的供应,易患( )
A.甲状腺亢进 B.佝偻病 C.地方性甲状腺肿 D.糖尿病
(3)可用盐酸酸化的碘化钾和淀粉检验食盐中的碘酸钾,反应的化学方程式为__________________,氧化产物与还原产物的物质的量之比为__________,能观察到的明显现象是___________________________________________________________。
(4)已知KIO3可用电解方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定电流强度和温度下电解KI溶液。总反应的化学方程式为:KI+3H2O KIO3+3H2↑,则两极反应式分别为:阳极_________________________,阴极__________________________。
KIO3+3H2↑,则两极反应式分别为:阳极_________________________,阴极__________________________。
(5)在某温度下,若以12 A的电流强度电解KI溶液10min,理论上可得标况下氢气________L。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com