
题目列表(包括答案和解析)
C(s)+H2O(g)![]() CO(g)+H2(g);DH>0
CO(g)+H2(g);DH>0
已知平衡时,CO为0.12mol.试填空:
(1)若用v(H2O)表示该反应前20s内平均速率,则v(H2O)=________.
(2)若在上述平衡混合物中加入少量Na2O固体,并在此温度下再次达到新的平衡(第二平衡),则平衡时H2的物质的量________(填“增大”“减小”或“不变”).理由是________.
(3)若向上述第一平衡的混合物中再充入amolH2(a<0.12)在相同条件下达到新的平衡(第三平衡),此时CO的物质的量n的范围是________.
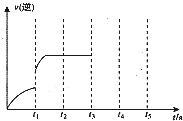 (2012?武汉模拟)一定温度下在固定容积为5.0L的密闭容器中发生可逆反应.
(2012?武汉模拟)一定温度下在固定容积为5.0L的密闭容器中发生可逆反应.| c(CO)?c(H2) |
| c(H2O) |
| 0.030 |
| t2-t1 |
| 0.030 |
| t2-t1 |
碳及其化合物有广泛的用途。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+ H2O(g)  CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是 。(填序号)
CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是 。(填序号)
| A.升高温度 | B.增加碳的用量 | C.加入催化剂 | D.用CO吸收剂除去CO |
 2CO(g) △H=+172.5kJ?mol-1
2CO(g) △H=+172.5kJ?mol-1 CO2(g)+H2(g)的焓变△H=
CO2(g)+H2(g)的焓变△H=  CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为: 。
CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为: 。 CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:| 温度/℃ | 起始量/mol | 平衡量/mol[学科 | 达到平衡所x需时间/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
 2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。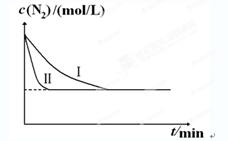

 2NO(g)的平衡常数K如下表
2NO(g)的平衡常数K如下表 

 2NO(g)达到平衡时NO的浓度。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)
2NO(g)达到平衡时NO的浓度。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)  2NO(g)的平衡常数K如下表
2NO(g)的平衡常数K如下表 

 2NO(g)达到平衡时NO的浓度。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)
2NO(g)达到平衡时NO的浓度。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字) 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com