
题目列表(包括答案和解析)
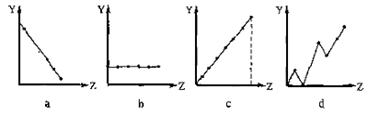
(13分) (1)(3分)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。请把与下面元素有关性质相符的曲线标号(a、b、c、d)填入相应的空格中:
①ⅡA族元素的最外层电子数 ▲ 。 ②第3周期元素的最高化合价 ▲ 。
③F-、 Na+ 、Mg2+、Al3+的离子半径 ▲ 。
(2)(10分)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子
最外层电子数与核外电子总数之比为3∶4;M原子的最外层电子数与次外电子数之比为
3∶4;N-、Z+、X+离子半径逐渐减小;化合物XN常温下为气体,据此回答:
①Y和M形成的常见化合物的化学式是 ▲ 。
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1∶1∶1,若A能抑制水的电离,B能促
进水的电离,则化合物A的化学式为 ▲ ,B的化学式是 ▲ 。
③Z与Y形成的稳定化合物的电子式为 ▲ 。
④X与Y、X与M均可形成18电子分子,写出这两种分子在水溶液中反应生成M单质的化学方程式: ▲
该反应中转移的电子数目为 ▲ 。
(13分) (1)(3分)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。请把与下面元素有关性质相符的曲线标号(a、b、c、d)填入相应的空格中:
①ⅡA族元素的最外层电子数 ▲ 。 ②第3周期元素的最高化合价 ▲ 。
③F-、 Na+ 、Mg2+、Al3+的离子半径 ▲ 。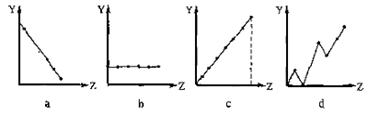
(2)(10分)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子
最外层电子数与核外电子总数之比为3∶4;M原子的最外层电子数与次外电子数之比为
3∶4;N-、Z+、X+离子半径逐渐减小;化合物XN常温下为气体,据此回答:
①Y和M形成的常见化合物的化学式是 ▲ 。
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1∶1∶1,若A能抑制水的电离 ,B能促
,B能促
进水的电离,则化合物A的化学式为 ▲ ,B的化学式是 ▲ 。
③Z与Y形成的稳定化合物的电子式为 ▲ 。
④X与Y、X与M均可形成18电子分子,写出这两种分子在水溶液中反应生成M单质的化学方程式: ▲
该反应中转移的电子数目 为 ▲ 。
为 ▲ 。
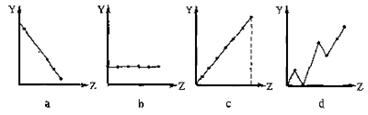
(13分) (1)(3分)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。请把与下面元素有关性质相符的曲线标号(a、b、c、d)填入相应的空格中:
①ⅡA族元素的最外层电子数 ▲ 。 ②第3周期元素的最高化合价 ▲ 。
③F-、 Na+ 、Mg2+、Al3+的离子半径 ▲ 。

(2)(10分)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子
最外层电子数与核外电子总数之比为3∶4;M原子的最外层电子数与次外电子数之比为
3∶4;N-、Z+、X+离子半径逐渐减小;化合物XN常温下为气体,据此回答:
①Y和M形成的常见化合物的化学式是 ▲ 。
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1∶1∶1,若A能抑制水的电离,B能促
进水的电离,则化合物A的化学式为 ▲ ,B的化学式是 ▲ 。
③Z与Y形成的稳定化合物的电子式为 ▲ 。
④X与Y、X与M均可形成18电子分子,写出这两种分子在水溶液中反应生成M单质的化学方程式: ▲
该反应中转移的电子数目为 ▲ 。
 ,B能促
,B能促  为 ▲ 。
为 ▲ 。(15分)
MnO2在酸性溶液中具有强氧化性,可被还原为Mn2+,它还对H2O2的分解具有良好的催化效果。某兴趣小组通过实验研究MnO2的性质
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是 。
| A.把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红 |
| B.把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红 |
| C.把MnO2固体加入到Na2SO3溶液中,再加入BaCl2观察是否有白色沉淀生成 |
| D.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成 |
| 实验 | 酸或碱 | 现象 |
| A | 1滴0.2mol/LNaOH溶液 | 不变色 |
| B | 1滴水 | 缓慢变浅棕褐色 |
| C | 1滴0.1mol/L硫酸溶液 | 迅速变棕褐色 |




湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com