A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图(反应条件和部分产物略去).
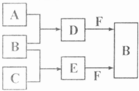
试回答:
(1)E的电子式是
.
(2)单质X和B或D均能反应生成黑色磁性固体Y,Y的化学式是
Fe3O4
Fe3O4
.
(3)物质Z常用于对空气进行杀菌、净化和水果保鲜等.Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18.Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是
O3+2H++2I-=O2+I2+H2O
O3+2H++2I-=O2+I2+H2O
.
(4)取0.3mol F与足量D充分混合后,所得溶液中再通入0.2mol E充分反应,最后得到的水溶液中各种离子的浓度由大到小的顺序是(不考虑H
+)
c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)
c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)
.
(5)E的大量排放会引发很多环境问题.有科学家提出,用E和H
2合成CH
3OH和H
2O,对E进行综合利用.25℃,101kPa时,该反应的热化学方程式是
CO2(g)+3H2(g)=CH3OH(l)+H2O(1)△H=-130.9kJ/mol
CO2(g)+3H2(g)=CH3OH(l)+H2O(1)△H=-130.9kJ/mol
.(已知甲醇的燃烧热△H=-726.5kJ?mol
-1,氢气的燃烧热△H=-285.8kJ?mol
-1)


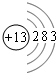

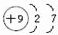
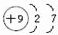
 试回答:
试回答:

 A、【供选学《化学与生活》考生作答】
A、【供选学《化学与生活》考生作答】