
题目列表(包括答案和解析)
[化学一物质结构与性质〕
1、有E、Q、T、X、Z 五种前四周期元素,原子序数E<Q<T<<<Z。E、Q、T三种元素的基态原子具有相同的能级,且,I1(E)<I1(T)<I1(Q),其中基态Q原子的2p轨道处于半充满状
态,且QT+ 2与ET2互为等电子体。X为周期表前四周期中电负性最小的元素,Z的原子序数为28。
请回答下列问题(答题时如需表示具体元素,请用相应的元素符号):
(1)写出QT+ 2的电子式 ,基态Z原子的核外电子排布式 ;
(2)Q的简单氢化物极易溶于T的简单氢化物,其主要原因有 等两种;
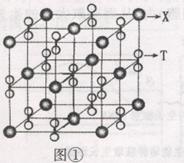
(3)化合物甲由T、X两种元素组成,其晶胞如图①,甲的化学式为 ;
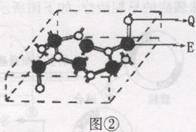
(4)化合物乙的晶胞如图②,乙由E、Q两种元素组成,硬度超过金刚石。
①乙的晶体类型为 ;
②乙的晶体中E、Q两种元素原子的杂化方式均为 。
〔化学一物质结构与性质〕
有E、Q、T、X、Z 五种前四周期元素,原子序数E<Q<T<<<Z。E、Q、T三种元素的基态原子具有相同的能级,且,I1(E)<I1(T)<I1(Q),其中基态Q原子的2p轨道处于半充满状
态,且QT+ 2与ET2互为等电子体。X为周期表前四周期中电负性最小的元素,Z的原子序数为28。
请回答下列问题(答题时如需表示具体元素,请用相应的元素符号):
(1)写出QT+ 2的电子式 ,基态Z原子的核外电子排布式 ;
(2)Q的简单氢化物极易溶于T的简单氢化物,其主要原因有 等两种;
(3)化合物甲由T、X两种元素组成,其晶胞如图①,甲的化学式为 ;
(4)化合物乙的晶胞如图②,乙由E、Q两种元素组成,硬度超过金刚石。
①乙的晶体类型为 ;
②乙的晶体中E、Q两种元素原子的杂化方式均为 。
 |
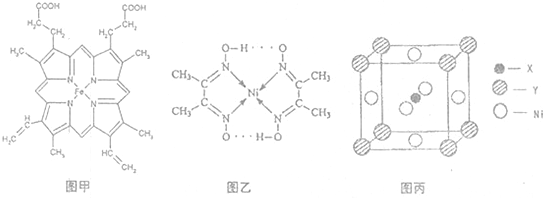

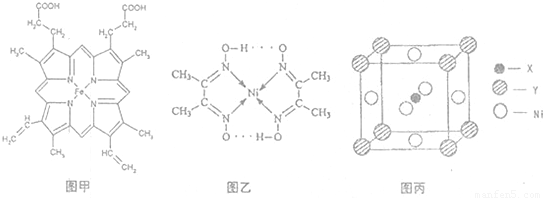
 ,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为______.
,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为______.[化学-物质结构与性质]X、Y、Z、W是元素周期表前四周期的4种常见元素,其相关信息如下表:

(1)Y位于元素周期表第________周期________族;Y和Z的最高价氧化物对应的水化物的酸性较强的是________(写化学式).
(2)XY2是一种常见溶剂,XY2的分子中存在________个σ键.在H-Y、H-Z两种共价键中,键的极性较强的是________(用化学式表示),键长较长的是________(用化学式表示).
(3)W的基态原子核外电子排布式是________.
W2Y在空气中煅烧生成W2O的化学方程式是:________.
(4)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y.已知:
XO(g)+1/2O2(g)=XO2(g);ΔH=-283.0 kJ/mol
Y(s)+O2(g)=YO2(g);ΔH=-296.0 kJ/mol
此反应的热化学方程式是:________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com