
题目列表(包括答案和解析)
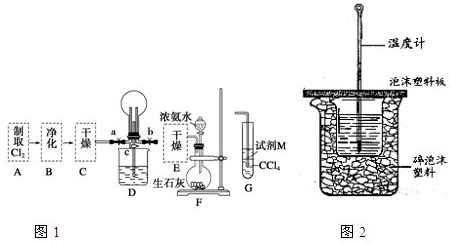
| ||
| ||

某化学兴趣小组在学习“硫酸盐的某些性质和用途”中,进行了如下实验探究:
【实验一】检验(NH4)2Fe(SO4)2·6H2O溶液中含有的阳离子。
(1)在下表中写出操作步骤和实验现象:
限选试剂:新制氯水、1mol/LH2SO4溶液、0.1mol/L KSCN溶液、NaOH浓溶液、浓盐酸、1mol/LNa2CO3溶液
|
操 作 步 骤 |
实验现象 |
结 论 |
|
步骤I:取少量待检液于试管中, 。 |
|
溶液中含有Fe2+ |
|
步骤II:取少量待检液于试管中, 。 |
|
溶液中含有NH4+ |
【实验二】用KHSO4制取H2O2并测其质量分数:
查阅资料得知:工业上用电解KHSO4饱和溶液可制取一定浓度的H2O2。兴趣小组进行下列实验测定H2O2的质量分数。已知:2MnO4-+5H2O2+6H+= 2Mn2++8H2O+5O2↑
操作①:取5.00 mL H2O2溶液(密度为1.00 g/mL)置于锥形瓶中加水稀释,再加稀硫酸酸化;
操作②:用0.1000 mol/L KMnO4溶液滴定;
操作③:用同样方法滴定,四次消耗KMnO4溶液的体积分别为20.00 mL、19.98 mL、20.02 mL、22.00 mL。
回答下列问题:
(2)操作②中,开始滴入KMnO4溶液时反应速率很慢,随着KMnO4溶液滴入反应速率显著加快,最有可能的原因______________________。
(3)滴定时盛装KMnO4溶液应选取的仪器是 (填序号)。
A.50mL酸式滴定管 B.50mL碱式滴定管
C.25mL酸式滴定管 D.25mL碱式滴定管
(4)在上述实验中,下列操作会造成测定结果偏高的有 (填序号)。
A.锥形瓶用待测液润洗
B.量取 H2O2溶液的滴定管用蒸馏水洗净,未用H2O2溶液润洗
C.滴定速度过快,又未摇匀,停止滴定后发现紫红色褪去
D.滴定前读数时平视,滴定终点读数时仰视
(5)分析数据,计算H2O2溶液中溶质的质量百分含量为___________(保留三位有效数字)。
某化学兴趣小组在学习“硫酸盐的某些性质和用途”中,进行了如下实验探究:
【实验一】检验(NH4)2Fe(SO4)2·6H2O溶液中含有的阳离子。
(1)在下表中写出操作步骤和实验现象:
限选试剂:新制氯水、1mol/LH2SO4溶液、0.1mol/L KSCN溶液、NaOH浓溶液、浓盐酸、1mol/LNa2CO3溶液
| 操 作 步 骤 | 实验现象 | 结 论 |
| 步骤I:取少量待检液于试管中, 。 | | 溶液中含有Fe2+ |
| 步骤II:取少量待检液于试管中, 。 | | 溶液中含有NH4+ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com