
题目列表(包括答案和解析)
Ⅰ.在体积恒定的密闭容器中,充入2mol CO2和5mol H2,一定条件下发生反应: CO2(g) + 3H2(g)  CH3OH(g)
+ H2O(g) △H = -49.0 kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示:
CH3OH(g)
+ H2O(g) △H = -49.0 kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示:

(1)从反应开始到第10min,H2的转化率为 ,在 该条件下,反应的平衡常数K= ,如果在某一时刻保持温度不变,只改变浓度,使c(CO2)=1.00mol/L,c(H2)=0.40mol/L,c(CH3OH)=c(H2O)=0.80mol/L,则平衡 (选填序号)。
a.向正向移动 b.向逆向移动
c.不移动 d.无法确定平衡移动方向
(2)下列措施中能使n(CH3OH)/n(CO2)增大的是 (选填序号)。
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离 d.再充入l mol CH3OH(g)
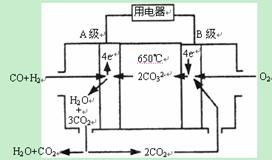
II.熔融碳酸盐燃料电池(MCFS),发明于1889年。现有一个碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示。请回答下列问题:

(1)A电极的电极反应方程式为 。
(2)常温下,用石墨作电极,以此电源电解一定量的CuSO4 溶液。当两极产生的气体体积相同时停止通电,若电解后溶液的体积为2L,溶液的pH=1(不考虑水解产生的H+),则阳极产生的气体的物质的量是 。
Ⅰ.在体积恒定的密闭容器中,充入2mol CO2和5mol H2,一定条件下发生反应: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) △H =" -49.0" kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示:
CH3OH(g) + H2O(g) △H =" -49.0" kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示: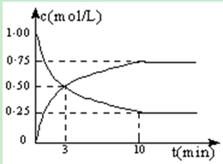
(1)从反应开始到第10min,H2的转化率为 ,在 该条件下,反应的平衡常数K= ,如果在某一时刻保持温度不变,只改变浓度,使c(CO2)=1.00mol/L,c(H2)=0.40mol/L,c(CH3OH)=c(H2O)=0.80mol/L,则平衡 (选填序号)。
a.向正向移动 b.向逆向移动
c.不移动 d.无法确定平衡移动方向
(2)下列措施中能使n(CH3OH)/n(CO2)增大的是 (选填序号)。
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离 d.再充入l mol CH3OH(g)
II.熔融碳酸盐燃料电池(MCFS),发明于1889年。现有一个碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示。请回答下列问题:
(1)A电极的电极反应方程式为 。
(2)常温下,用石墨作电极,以此电源电解一定量的CuSO4 溶液。当两极产生的气体体积相同时停止通电,若电解后溶液的体积为2L,溶液的pH=1(不考虑水解产生的H+),则阳极产生的气体的物质的量是 。
 CH3OH(g) + H2O(g) △H =" -49.0" kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示:
CH3OH(g) + H2O(g) △H =" -49.0" kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示: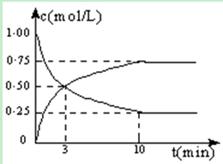
恒温、恒压下,在一个可变容积的密闭容器中发生如下反应:
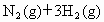
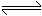
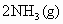
写出该反应的化学平衡常数表达式:K=__________
Ⅰ.若开始时放入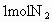 和
和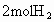 ,到达平衡后,生成
,到达平衡后,生成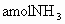 .求:(1)平衡时
.求:(1)平衡时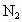 的物质的量为________mol.(用含a的式子表示,以下同)
的物质的量为________mol.(用含a的式子表示,以下同)
(2)原混合气体与平衡混合气体的总物质的量之比,n(始)∶n(平)=________.
(3)达到平衡时,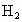 的转化率是_______.
的转化率是_______.
(4)若开始时放入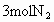 和
和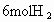 ,到达平衡后,生成
,到达平衡后,生成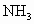 的物质的量为____________mol.
的物质的量为____________mol.
Ⅱ.若维持温度不变,在一个与I反应前起始体积相同、且容积固定的容器中发生上述反应.开始时放入1mol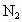 和2mol
和2mol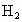 到达平衡后生成bmol
到达平衡后生成bmol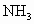 .将b与Ⅰ中的a进行比较__________(选填一个编号).
.将b与Ⅰ中的a进行比较__________(选填一个编号).
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
恒温、恒压下,在一个可变容积的密闭容器中发生如下反应:
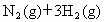
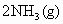
写出该反应的化学平衡常数表达式:K=__________
Ⅰ.若开始时放入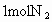 和
和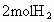 ,到达平衡后,生成
,到达平衡后,生成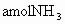 .求:(1)平衡时
.求:(1)平衡时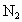 的物质的量为________mol.(用含a的式子表示,以下同)
的物质的量为________mol.(用含a的式子表示,以下同)
(2)原混合气体与平衡混合气体的总物质的量之比,n(始)∶n(平)=________.
(3)达到平衡时,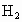 的转化率是_______.
的转化率是_______.
(4)若开始时放入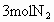 和
和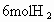 ,到达平衡后,生成
,到达平衡后,生成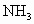 的物质的量为____________mol.
的物质的量为____________mol.
Ⅱ.若维持温度不变,在一个与I反应前起始体积相同、且容积固定的容器中发生上述反应.开始时放入1mol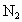 和2mol
和2mol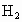 到达平衡后生成bmol
到达平衡后生成bmol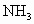 .将b与Ⅰ中的a进行比较__________(选填一个编号).
.将b与Ⅰ中的a进行比较__________(选填一个编号).
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com