
题目列表(包括答案和解析)
某活动小组设计了以下实验,其实验目的是观察两份完全相同的铁粉与铝粉的混合物分别与足量盐酸和NaOH溶液反应的删程;测定部分数据对混合物的成分进行定量分析。
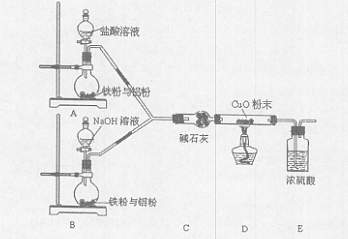
请回答:
(1)碱石灰的作用是 。
(2)下列操作进行的顺序由先到后的是 (填序号)。
①同时打开A、B中分液漏斗的活塞,分别加人足量试剂
②检查装置的气密性 ③点燃酒精灯
④装入药品 ⑤熄灭酒精灯
⑥同时关闭A、B中分液漏斗的活塞
(3)写出B装置中发生反应的离子方程式: 。
(4)写出装置A、B中实验现象的不同点 。
(5)该装置不够完善,还需增加的装置为 。
(6)已知反应前金属混合物的质量,发生反应后测定混合物成分的最简单方法是 。
(7)若混合金属中铁与铝的质量比为28:27,则充分反应后,A和B两烧瓶中转移电子总数之比为 。
某活动小组设计了以下实验,其实验目的是观察两份完全相同的铁粉与铝粉的混合物分别与足量盐酸和NaOH溶液反应的删程;测定部分数据对混合物的成分进行定量分析。
请回答:
(1)碱石灰的作用是 。
(2)下列操作进行的顺序由先到后的是 (填序号)。
①同时打开A、B中分液漏斗的活塞,分别加人足量试剂
②检查装置的气密性 ③点燃酒精灯
④装入药品 ⑤熄灭酒精灯
⑥同时关闭A、B中分液漏斗的活塞
(3)写出B装置中发生反应的离子方程式: 。
(4)写出装置A、B中实验现象的不同点 。
(5)该装置不够完善,还需增加的装置为 。
(6)已知反应前金属混合物的质量,发生反应后测定混合物成分的最简单方法是 。
(7)若混合金属中铁与铝的质量比为28:27,则充分反应后,A和B两烧瓶中转移电子总数之比为 。
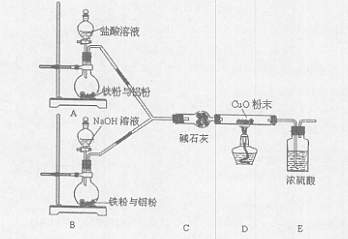
某活动小组设计了以下实验,其实验目的是观察两份完全相同的铁粉与铝粉的混合物分别与足量盐酸和NaOH溶液反应的删程;测定部分数据对混合物的成分进行定量分析。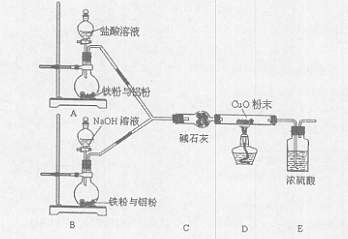
请回答:
(1)碱石灰的作用是 。
(2)下列操作进行的顺序由先到后的是 (填序号)。
①同时打开A、B中分液漏斗的活塞,分别加人足量试剂
②检查装置的气密性 ③点燃酒精灯
④装入药品 ⑤熄灭酒精灯
⑥同时关闭A、B中分液漏斗的活塞
(3)写出B装置中发生反应的离子方程式: 。
(4)写出装置A、B中实验现象的不同点 。
(5)该装置不够完善,还需增加的装置为 。
(6)已知反应前金属混合物的质量,发生反应后测定混合物成分的最简单方法是 。
(7)若混合金属中铁与铝的质量比为28:27,则充分反应后,A和B两烧瓶中转移电子总数之比为 。
(11分)纯碱、烧碱等是重要的化工原料。
(1)利用如图所示装置可间接证明二氧化碳与烧碱溶液发生了反应。将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是 。若其它操作不变,将A与C连接,可观察到的现象是 。
(2)向100 mL2 mol/L的NaOH 溶液中通入一定量CO2,结晶,得到9.3 g白色固体,该白色固体的组成是 (写化学式)。
设计实验确认该白色固体中存在的阴离子,试完成下列方案。
| 实验操作 | 实验现象 | 结论 | |
| ① 取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 |
|
| |
| ② 过滤,取2 mL滤液于试管中 | |||
| ③ |
|
| |
(3)现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
已知NaHCO3在低温下溶解度较小。反应I为:
NaCl+CO2+NH3+H2ONaHCO3↓+NH4Cl,处理母液的两种方法如下。
① 向母液中加入石灰乳,可将其中 循环利用,同时得到融雪剂 。
② 向母液中通入NH3,加入细小的食盐颗粒并降温,可得到NH4Cl晶体。
试写出通入NH3后,溶解度较小的酸式碳酸盐转变为溶解度较大的碳酸盐的离子方程式:_______________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com