
题目列表(包括答案和解析)
化学实验是研究物质性质的基础。下列有关实验操作或测量数据合理的是:
A.用铁坩埚加热CuSO4·5H2O晶体测定结晶水质量分数
B.用干燥的pH试纸测定浓硫酸的pH
C.用规格为20 mL的量筒,量取16.8 mL的Na2CO3溶液
D.KMnO4溶液应装在碱式滴定管中
化学实验是研究物质性质的基础。下列有关实验操作或测量数据合理的是:
A.用铁坩埚加热CuSO4·5H2O晶体测定结晶水质量分数
B.用干燥的pH试纸测定浓硫酸的pH
C.用规格为20 mL的量筒,量取16.8 mL的Na2CO3溶液
D.KMnO4溶液应装在碱式滴定管中
化学实验是研究物质性质的基础。下列有关实验操作或测量数据合理的是:
A.用铁坩埚加热CuSO4·5H2O晶体测定结晶水质量分数
B.用干燥的pH试纸测定浓硫酸的pH
C.用规格为20 mL的量筒,量取16.8 mL的Na2CO3溶液
D.KMnO4溶液应装在碱式滴定管中
化学实验是研究物质性质的基础。
(1)下列有关实验操作或测量数据合理的是________(填序号)。
a.用铁坩埚加热CuSO4·5H2O晶体测定结晶水质量分数
b.用干燥的pH试纸测定浓硫酸的pH
c.用规格为20 mL的量筒,量取16.8 mL的Na2CO3溶液
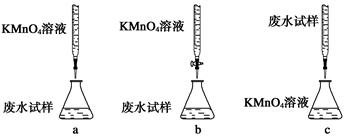
(2)某废水样品中含有一定量的Na+、CO32-、SO32-,某研究小组欲测定其中SO32-的浓度。
实验方案:
ⅰ.用烧杯盛取废水适量,加少量活性炭,除去废水中的杂质;过滤,取滤液;
ⅱ.精确量取20.00 mL过滤后废水试样,选择使用紫色的0.1 mol/L KMnO4(H2SO4酸化)溶液进行滴定;
ⅲ.记录数据,计算。
①下列滴定方式中,最合理的是(夹持部已分略去)______(填字母序号)。
②滴定过程中,有关反应的离子方程式是__________________________________。
(3)某同学制备Fe(OH)3胶体:用洁净的烧杯取适量蒸馏水加热至沸腾,向烧杯中滴加 1 mol/L的FeCl3溶液,并不断用玻璃棒搅拌,结果溶液变浑浊。该同学制备胶体失败的原因是 ,你认为成功制得Fe(OH)3胶体的特征现象是_________。
(4)用下图装置进行CO2性质的有关实验。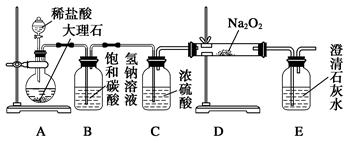
试剂瓶B中盛有饱和NaHCO3溶液,其目的是:
_______________________ __________。
②反应过程中,E中澄清石灰水变浑浊,E中的混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示该溶解平衡关系:
____________________ ___________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com