
题目列表(包括答案和解析)
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:N2(g)+2O2(g)=2NO2(g) ΔH="+67.7kJ/mol," 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ΔH=-1135.7kJ/mol,下列说法正确的是
| A.N2H4(g)+O2(g)=N2(g)+2H2O(g)ΔH=-1068 kJ/mol |
| B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O=N2H5+ + OH- |
| C.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,放电时的负极反应式:N2H4-4e-+4OH-=N2↑+4H2O |
| D.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,工作一段时间后,KOH溶液的pH将增大 |
肼(N2H4)又称联氨,是一种可燃性液体,用作火箭燃料。
(1)32.0g该液态化合物在氧气中完全燃烧生成氮气放出热量624kJ(25°C,101kPa),则肼完全燃烧的热化学方程式 。
 (2)肼——空气燃料电池是一种无污染的清洁的碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时,作负极的燃料是 (填化学式);正极的电极反应式是 。
(2)肼——空气燃料电池是一种无污染的清洁的碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时,作负极的燃料是 (填化学式);正极的电极反应式是 。
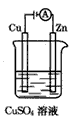
(3)右图是一个电化学过程示意图。
①锌片上发生的电极反应是________________________。
②假设使用肼一空气燃烧电池作为本过程中的电源,锌片的质量
变化是128g,则肼一空气燃料电池理论上消耗标准状况下的空气_____L
(假设空气中氧气体积含量为20%)
(15分)
肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料。
(1)已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/tool
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=一1135.7kJ/mol
则肼完全燃烧的热化学方程式为 。
(2)肼——空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时,正极的电极反应式是 ,电池工作一段时间后,电解质溶液的pH将 (填“增大”、“减小”、“不变”)。 (3)右图是一个电化学装置示意图。用肼——空气燃料电池做此装置的电源。
(3)右图是一个电化学装置示意图。用肼——空气燃料电池做此装置的电源。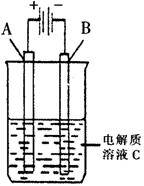
①如果A为含有锌、银、金三种杂质的粗铜,B为纯铜,C为CuSO4。该装置的实际意义是 。
②如果A是铂电极,B是石墨电极,C是AgNO3溶液,若B极增重10.8g,该燃料电池理论上消耗 molN2H4。
(4)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因 。
(5)常温下将0.2mol/L HCl溶液与0.2mol/L N2H4·H2O溶液等体积混合(忽略混合后溶液体积的变化),若测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+) 0.1mol/LHCl溶液中由水电离出的c(H+)(填“大于”、“小于”、或“等于”)。
(6)已知:在相同条件下N2H4·H2O的电离程度大于N2H5C1的水解程度。常温下,若将0.2mol/L N2H4·H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H-5、Cl-、OH-、H+离子浓度南大到小的顺序为 。
(15分)
肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料。
(1)已知:N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ/tool
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=一1135.7kJ/mol
则肼完全燃烧的热化学方程式为 。
(2)肼——空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时,正极的电极反应式是 ,电池工作一段时间后,电解质溶液的pH将 (填“增大”、“减小”、“不变”)。
(3)右图是一个电化学装置示意图。用肼——空气燃料电池做此装置的电源。
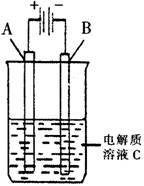
①如果A为含有锌、银、金三种杂质的粗铜,B为纯铜,C为CuSO4。该装置的实际意义是 。
②如果A是铂电极,B是石墨电极,C是AgNO3溶液,若B极增重10.8g,该燃料电池理论上消耗 molN2H4。
(4)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因 。
(5)常温下将0.2mol/L HCl溶液与0.2mol/L N2H4·H2O溶液等体积混合(忽略混合后溶液体积的变化),若测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+) 0.1mol/LHCl溶液中由水电离出的c(H+)(填“大于”、“小于”、或“等于”)。
(6)已知:在相同条件下N2H4·H2O的电离程度大于N2H5C1的水解程度。常温下,若将0.2mol/L N2H4·H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H-5、Cl-、OH-、H+离子浓度南大到小的顺序为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com