
题目列表(包括答案和解析)
| V2 |
| a2 |
| V2 |
| a2 |

| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol CH3OCH3、1mol H2O | 2mol CH3OH | 1mol CH3OH |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 吸收a kJ | 放出b kJ | 放出c kJ |
| 平衡时体积(L) | V1 | V2 | V3 |
| 反应物转化率 | α 1 | α 2 | α 3 |

二甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能。四川是利用天然气生产二甲醚的重要基地之一,四川汶川大地震对该地二甲醚的生产影响较大。
请填写下列空白:
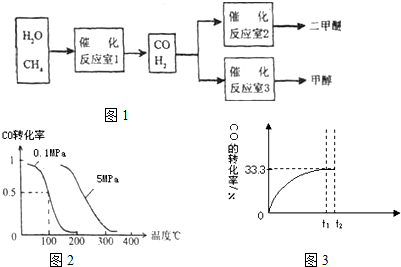
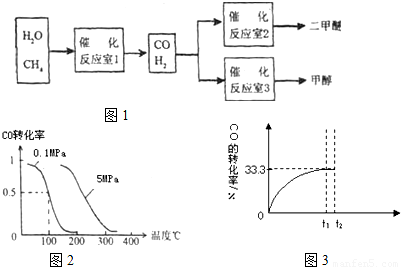
⑴二甲醚可由合成气(CO+H2)在一定条件下制得。用合成气制二甲醚时,还产生了可参与大气循环的无机化合物水或二氧化碳,该反应的化学方程式可能是: 。
⑵乙醚(CH3CH2OCH2CH3)是二甲醚的同系物,既是常见的有机溶剂又是很好的麻醉剂,在汶川大地震救死扶伤的过程中起了一定的作用。写出两种与乙醚相对分子质量相等且元素种类相同,分子中含有两个甲基的非醇类有机物的结构简式 ; 。
⑶以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极构成燃料电池。该电池的化学反应方程式是: 。
⑷用二甲醚燃料电池为电源,用铂电极电解KCl和CuSO4的混合溶液,当电路中通过0.3mol电子的电量时,阴阳两极都产生2.8L的气体(标准状况),若电解后溶液体积为1L,则
①试判断阴极气体的成分。
②通过计算求阳极气体的成分及物质的量。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com