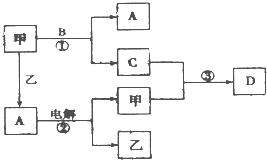
A、B、C、D是由短周期元素组成的四种常见的化合物,D为红棕色气体,甲、乙是两种单质,这些单质和化合物之间存在如图所示的转化关系:
(1)上述转化过程中包含的反应类型有
BC
BC
(填序号)
A.置换反应B.化合反应C.分解反应D.复分解反应
(2)在反应②中,阳极的电极反应方程式为
4OH--4e-=2H2O+O2↑
4OH--4e-=2H2O+O2↑
;
(3)乙在甲中燃烧,当有1mol电子转移,生成液态A时,放出142.9kJ的热量,则该反应的热化学方程式为
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol
;
(4)反应③在一定条件下为可逆反应,若将3mol甲和4molC混合充入2L的密闭容器中,2min后达到平衡.平衡后混合气体的总物质的量为6mol,则甲的反应速率为
0.25mol/(L.min)
0.25mol/(L.min)
,该平衡混合气体溶于水,恰好完全被水吸收,该反应的总化学方程式为
NO+NO2+O2+H2O═HNO3
NO+NO2+O2+H2O═HNO3
.
(5)胶态磁流体在医学上有重要的用途,而纳米级Fe
3O
4是磁流体中的重要粒子,其制备过程简单表示如下:
①将气体B通入等物质的量混合的FeSO
4、Fe
2(SO
4)
3溶液中,生成两种碱,写出该过程的总离子方程式:
Fe2++2Fe3++8NH3.H2O═Fe(OH)2↓+2Fe(OH)3↓+NH4+
Fe2++2Fe3++8NH3.H2O═Fe(OH)2↓+2Fe(OH)3↓+NH4+
;
②上述反应生成的两种碱继续作用,得到Fe
3O
4,该反应的化学方程式为
Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O
Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O
.



 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:

 A、B、C、D是由短周期元素组成的四种常见的化合物,D为红棕色气体,甲、乙是两种单质,这些单质和化合物之间存在如图所示的转化关系:
A、B、C、D是由短周期元素组成的四种常见的化合物,D为红棕色气体,甲、乙是两种单质,这些单质和化合物之间存在如图所示的转化关系: