有一化合物X(不含结晶水),其水溶液为浅绿色,可发生如下的转化关系(部分反应物,生成物已略).其中B、D、E、F均为无色气体.M、L为常见的金属单质,C为难溶于水的红褐色固体.在混合液中加入BaCl
2溶液可生成不溶于稀盐酸的白色沉淀,H和M反应可放出大量的热.
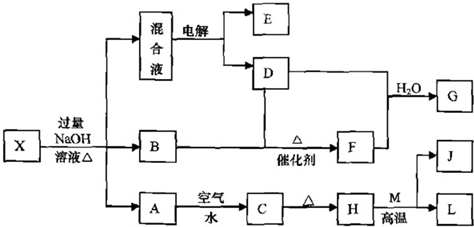
请回答下列问题:
(1)B物质的电子式为
;B气体的检验方法为
.
(2)按要求写出上述转化关系中有关反应的化学方程式:
①含有L元素的化合反应:
;
②含有L元素的置换反应:
.
(3)L与过量C的稀溶液反应的离子方程式为
.
(4)物质X的化学式为
.
(5)物质X溶于水结晶析出晶体的组成可表示为X?nH
2O,为测定n.称取WgX?nH
2O晶体溶于水中,配制100mL溶液,再用滴定管取出10.00mL,用Cmol?L
-l的酸性KMnO
4溶液进行滴定,滴定所发生反应为:5L
2++MnO
4-+8H
+=5L
3++Mn
2++4H
2O达到滴定终点时,共用酸性KMnO
4溶液VmL,则所配X溶液的溶质的物质的量浓度为
mol?L
-1,由此算出X?nH
2O晶体中结晶水的n值是
(以上答案用字母表示).

