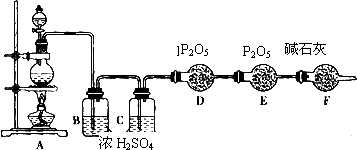
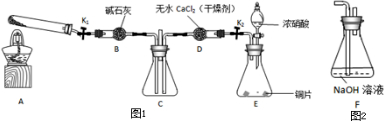
某化学课外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置.A中所用试剂,从下列固体物质中选取:①NH
4HCO
3、②NH
4Cl、③Ca(OH)
2、④NaOH.

检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯,铂丝继续保持红热,F处铜片逐渐溶解.
(1)实验室制取A中气体时若只用一种试剂,该试剂是
NH4HCO3
NH4HCO3
(填代表备选试剂的序号);此时A中主要的玻璃仪器有
试管、酒精灯
试管、酒精灯
(填名称).
(2)下面关于A中所用试剂的说法正确的是
C
C
.
A.施用该物质会大大提高粮食产量而对环境无影响
B.向该物质的溶液中加入足量氢氧化钡溶液发生反应的离子方程式为:NH
4++OH
-=NH
3?H
2O
C.可通过加热方法区别该试剂和(NH
4)
2SO
4D.工业上用NH
3等合成该物质的过程可称为氮的固定
(3)装置C中发生催化氧化反应的化学方程式为
,装置E发生反应的化学方程式为
2NH3+H2SO4=(NH4)2SO4
2NH3+H2SO4=(NH4)2SO4
.
(4)假设A、B中的药品充足,则装置F中可以观察到的现象有
水中产生气泡
水中产生气泡
溶液逐渐变为蓝色,气体在广口瓶上方变为红棕色
溶液逐渐变为蓝色,气体在广口瓶上方变为红棕色
.
(5)指导老师从安全与环保角度考虑,指出该装置有两处明显的缺陷,请你提出修改建议:
在装置E、F之间增加一个防倒吸装置,在装置F后面增加一个尾气吸收装置
在装置E、F之间增加一个防倒吸装置,在装置F后面增加一个尾气吸收装置
.