
题目列表(包括答案和解析)
| O | - 3 |
| O | -3 |
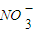
(1)下列生产、生活的事例中发生了氧化还原反应的是 。

(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如图表达。

试写出有水参加、水为还原剂且为类型Ⅳ的一个化学方程式: 。
(3)NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2反应的离子方程式是:

①请补充完整,配平方程式并标出电子转移的方向和数目。
②某同学称取了7.9 g KMnO4,固体,欲配制100 mL溶液。回答下列问题:
该实验中,使用容量瓶时要检查是否漏水,其操作是 。
③不规范的实验操作会导致实验结果的误差。下列操作会使实验结果偏小的是 (填序号)。
A.在溶解过程中有少量液体溅出烧杯外
B.定容时仰视容量瓶上的刻度线
C.定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线
④某同学用上述配好的KMnO4溶液滴定未知浓度的NaNO2溶液:取20 mL未知浓度的NaNO2溶液于锥形瓶;取上述配好的KMnO4溶液于________(填“酸式”或“碱式”)滴定管,滴定完成后消耗KMnO4溶液10 mL,则NaNO2溶液的浓度为________________。
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活的事例中发生了氧化还原反应的是 。
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如图表达。
试写出有水参加、水为还原剂且为类型Ⅳ的一个化学方程式: 。
(3)NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2反应的离子方程式是:
①请补充完整,配平方程式并标出电子转移的方向和数目。
②某同学称取了7.9 g KMnO4,固体,欲配制100 mL溶液。回答下列问题:
该实验中,使用容量瓶时要检查是否漏水,其操作是 。
③不规范的实验操作会导致实验结果的误差。下列操作会使实验结果偏小的是 (填序号)。
A.在溶解过程中有少量液体溅出烧杯外
B.定容时仰视容量瓶上的刻度线
C.定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线
④某同学用上述配好的KMnO4溶液滴定未知浓度的NaNO2溶液:取20 mL未知浓度的NaNO2溶液于锥形瓶;取上述配好的KMnO4溶液于________(填“酸式”或“碱式”)滴定管,滴定完成后消耗KMnO4溶液10 mL,则NaNO2溶液的浓度为________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com