
题目列表(包括答案和解析)
下列有关热化学方程式的叙述中,正确的是 ( )
A.含20.0g NaOH的稀溶液与足量的稀硫酸完全中和,放出28.7kJ的热量,则表示中[和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-114.8kJ/mol
B.已知热化学方程式:SO2(g)+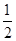 O2(g)
O2(g)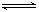 SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ
SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ
C.已知2H2(g)+O2(g)=2H2O(g); △H=-483.6kJ/mol,则H2的燃烧热为241.8kJ/mol
D.已知①S(s)+O2(g)=SO2(g); △H1 ②S(g)十O2(g)=SO2(g);△H2 则△H1>△H2
下列有关热化学方程式的叙述中,正确的是 ( )
| A.含20.0g NaOH的稀溶液与足量的稀硫酸完全中和,放出28.7kJ的热量,则表示中[和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H=-114.8kJ/mol |
B.已知热化学方程式:SO2(g)+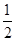 O2(g) O2(g) SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ |
| C.已知2H2(g)+O2(g)=2H2O(g); △H=-483.6kJ/mol,则H2的燃烧热为241.8kJ/mol |
| D.已知①S(s)+O2(g)=SO2(g); △H1②S(g)十O2(g)=SO2(g);△H2 则△H1>△H2 |
A.CO(g)的燃烧热是283.0kJ/mol,则表示CO(g)燃烧反应的热化学方程式为CO(g)+
| ||||
B.稀盐酸和稀氢氧化钠溶液反应的中和热为57.3kJ/mol,则表示稀硫酸与稀氢氧化钾溶液发生反应的热化学方程式为
| ||||
| C.铝热反应是放热反应,但需要足够的热量才能使反应发生 | ||||
| D.水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小 |
 H2SO4(l)+KOH(l)=
H2SO4(l)+KOH(l)= K2SO2(l)+H2O(l);△H=-57.3KJ/mol
K2SO2(l)+H2O(l);△H=-57.3KJ/mol O2(g)═CO2(g);△H=-283.0kJ/mol
O2(g)═CO2(g);△H=-283.0kJ/mol H2SO4(l)+KOH(l)═
H2SO4(l)+KOH(l)═ K2SO4(l)+H2O(l);△H=-57.3kJ/mol
K2SO4(l)+H2O(l);△H=-57.3kJ/mol湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com