
题目列表(包括答案和解析)
| 实验 序号 |
温度℃ | 初始CCl4浓度 (mol?L-1) |
初始H2浓度(mol?L-1) | CCl4的平衡转化率 |
| 1 | 110 | 0.8 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 100 | 1 | 1 | B |
| 催化剂 |
| △ |
| 实验序号 | 温度℃ | 初始CCl4浓度(mol?L-1) | 初始H2浓度(mol?L-1) | CCl4的转化率 |
| 1 | 110 | 0.8 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 100 | 1 | 1 | B |
| [CHCl3][HCl] |
| [H2][CCl4] |
| [CHCl3][HCl] |
| [H2][CCl4] |
(10分)为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿(CHCl3)。CCl4+H2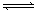 CHCl3+ HCl,此反应伴有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为770C,CHCl3的沸点为61.20C。在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应)
CHCl3+ HCl,此反应伴有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为770C,CHCl3的沸点为61.20C。在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应)
| 实验序号 | 温度0C | 初始CCl4浓度mol/L | 初始H2浓度mol/L | CCl4的平衡转化率 |
| 1 | 110 | 0.8 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 120 | 1 | 1 | B |
(10分)为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿(CHCl3)。CCl4+H2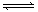 CHCl3+ HCl,此反应伴有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为770C,CHCl3的沸点为61.20C。在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应)
CHCl3+ HCl,此反应伴有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为770C,CHCl3的沸点为61.20C。在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应)
|
实验序号 |
温度0C |
初始CCl4浓度mol/L |
初始H2浓度mol/L |
CCl4的平衡转化率 |
|
1 |
110 |
0.8 |
1.2 |
A |
|
2 |
110 |
1 |
1 |
50% |
|
3 |
120 |
1 |
1 |
B |
(1)1100C时平衡常数:
(2)实验1中,CCl4的转化率A为:
(3)实验2中,10小时后达到平衡,H2的平均反应速率为: 。在此实验的平衡体系中,再加入1.0molCCl4和0.5molHCl,平衡将向 反应方向移动(填“正”、“逆”或“不移动”);
(4)实验3中,B的值
①等于50% ②大于50% ③小于50% ④无法判断
为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿(CHCl3)。
CCl4+H2 ![]() CHCl3+HCl 此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为 77℃,CHCl3的沸点为 61.2℃。(1)在密闭容器中,该反应在某催化剂下进行10 h,测得如下数据(假设不考虑副反应)。
CHCl3+HCl 此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为 77℃,CHCl3的沸点为 61.2℃。(1)在密闭容器中,该反应在某催化剂下进行10 h,测得如下数据(假设不考虑副反应)。
| 实验序号 | 温度℃ | 初始CCl4浓度(mol·L-1) | 初始H2浓度(mol·L-1) | CCl4的转化率 |
| 1 | 110 | 0.8 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 100 | 1 | 1 | B |
①此反应的化学平衡常数表达式为 ,在 110 ℃时平衡常数为 。
②实验1中,CCl4的转化率A 50%(填“大于”、“小于”或“等于”)。
③实验2中,10h后达到平衡,H2的平均反应速率为 。在此实验的平 衡体系中,再加入0.5 mol CCl4和1.0 mol HCl,平衡将向 方向移动。
④实验3中,B的值 (选填序号)。
A.等于50% B.大于50% C.小于50% D.从本题资料,无法判断
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com