
题目列表(包括答案和解析)
某溶液中的溶质由下列中的几种离子构成:Na+、Fe3+、Cu2+、Ba2+、AlO2—、CO32—、SO32—、SO42—。取该溶液进行有关实验,实验步骤及结果如下:
①向溶液中加入过量稀盐酸,得到气体甲和溶液甲;
②向溶液甲中加入过量NH4HCO3溶液,得到白色沉淀乙、气体乙和溶液乙;
③向溶液乙中加入过量Ba(OH) 2溶液,得到白色沉淀丙、气体丙和溶液丙。
④检验气体甲、气体乙、气体丙,都只含有一种成份,而且各不相同。
请回答下列问题:
(1)只根据实验①能得出的结论是 (3分)
(2)沉淀丙中一定含有 (1分),可能含有 (1分)
(3)该溶液中肯定存在的离子有
(4)气体乙分子的结构式为
(5)向溶液甲中加入NH4HCO3溶液至过量,该过程中可能发生反应的离子方程式为 ; ; (根据需要,可不填完,也可补充)
某溶液中的溶质由下列中的几种离子构成:Na+、Fe3+、Cu2+、Ba2+、AlO2—、CO32—、SO32—、SO42—。取该溶液进行有关实验,实验步骤及结果如下:
①向溶液中加入过量稀盐酸,得到气体甲和溶液甲;
②向溶液甲中加入过量NH4HCO3溶液,得到白色沉淀乙、气体乙和溶液乙;
③向溶液乙中加入过量Ba(OH) 2溶液,得到白色沉淀丙、气体丙和溶液丙。
④检验气体甲、气体乙、气体丙,都只含有一种成份,而且各不相同。
请回答下列问题:
(1)只根据实验①能得出的结论是 (3分)
(2)沉淀丙中一定含有 (1分),可能含有 (1分)
(3)该溶液中肯定存在的离子有
(4)气体乙分子的结构式为
(5)向溶液甲中加入NH4HCO3溶液至过量,该过程中可能发生反应的离子方程式为 ; ; (根据需要,可不填完,也可补充)
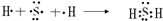
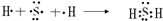

本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两
个选修模块的内容。请选择其中一题作答。若两题都做,则按A题评分。
A.微粒A、B、C为分子,D和F为阳离子,E为阴离子,它们都含有lO个电子;B溶
于A后所得的物质可电离出D和E;C是重要的化石能源。将A、B和含F离子的物
质混合后可得D和一种白色沉淀。G3+离子与Ar原子的电子层结构相同。请回答:
(1)基态G原子的外围电子排布式是 。在A、B、C这三种分子中,属于非极
性分子的有 (写化学式)。
(2)下列有关B的说法中正确的是 。(填字母)
a.在配合物中可作为配体 b.该分子的稳定性与氢键有关
c.分子由各原子最外层均为8![]() 。的稳定结构
。的稳定结构
d.含1 mol B的液体中有3 mol氢键
(3)根据等电子体原理,D离子的空间构型是 ,其中心原子轨道的杂化类型
 是 。
是 。
(4)构成C的中心原子可以形成多种单质,其中有一种为空间网状结
构,右图立方体中心的“●”表示该晶体中的一个原子,请在该
立方体的顶点上用“●”表示出与之紧邻的原子。
(5)光谱证实F与烧碱溶液反应有Na[F(OH)4]生成,则Na[F(OH)4]中
不存在 。(填字母)
a.金属键 b.离子键 c.非极性键 d.极性键
f.配位键 g.![]() 键 h.
键 h.![]() 键
键
B.对氨基苯磺酸是制取某些染料和药物的重要中间体,可由苯胺磺化得到:


实验室可用苯胺、浓硫酸为原料,利用右图所示实验装置合成。
实验步骤如下:
①取一个250mL的仪器a,加入10mL苯胺及几粒沸石,
放人冷水中冷却,小心地加入18 mL浓硫酸。再分别
装上冷凝管、温度计等。
②将a置于油浴中缓慢加热至170`180℃,维持此温度约2.5 h。
③将反应产物冷却至约50℃后,倒入盛有100mL,冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出。用该烧杯中的少量冷水将a内残留的产物冲洗到烧杯中,抽滤,用少量冷水洗涤,得到粗产品。
④将粗产品用沸水溶解,冷却结晶(若溶液颜色过深,可用活性炭脱色),抽滤,收集
产品,晾干。(提示:100mL水在20℃时可溶解对氨基苯磺酸1.08 g,在100℃时可
溶解6.67 g)
(1)仪器a的名称是 。步骤①中加入沸石的作用是 。
(2)步骤②中采用油浴加热,下列说法正确的是 。(填字母)
A.便于控制温度 B.也可以改用水浴加热 C.温度计的水银球也可浸在油中
(3)步骤③用冷水洗涤的优点是 。
(4)步骤③和④均进行了抽滤操作,在抽滤完毕停止抽滤时,应注意先一二,然
后 。
(5)步骤④有时需重复进行多次,其目的是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com