
题目列表(包括答案和解析)
 [化学-物质结构与性质]
[化学-物质结构与性质](12分)【化学——物质结构与性质】短周期元素A、B、C、D,A元素的原子最外层电子排布式为ms1,B元素的原子价电子排布式为ns2 np2,C元素位于第二周期且原子中p亚层与所有s亚层电子总数相等,D元素原子的L层的p亚层中有3个未成对电子。
(1)C元素原子基态时的价电子排布式 ,若A元素为非金属元素.A与C形成的化合物中的共价键属于 键(填“ ”或“
”或“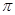 ”)。
”)。
(2)当n=2时.B的最简单气态氢化物的分子构型为 ,中心原子的杂化方式为 ,BC2属于 分子(填“极性”或“非极性”),当n=3时,B与C形成的晶体属于____ 晶体;
(3)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,A、B、C、D四种元素的第一电离能由大到小的顺序为 (填元素符号)。
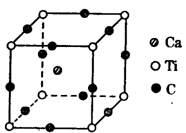
(4)下图为C元素与钛钙元素形成的某晶体结构中的最小重复单元,该晶体中每个钛原子周围与它最近且距离相等的钙离子有 个,该晶体的化学式为 。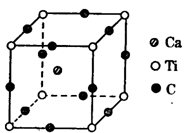
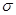 ”或“
”或“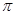 ”)。
”)。
| 元素 | Al | B | Be | C | Cl | F | Li |
| X | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | Fe |
| X | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 | 1.8 |



湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com