
题目列表(包括答案和解析)
有关短周期元素A、B、C、D、E、F的信息如下:
元素 有关信息
A 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐
B 最外层电子数是次外层电子数的2倍
C M层上有3个电子
D 短周期原子半径最大的主族元素
E 其单质是淡黄色固体
F 最高正价与最低负价代数和为6
请回答下列问题:
(1)写出实验室制取乙的化学方程式 。
(2)下列说法正确的是 (填序号)。
① 实验室可用如图所示装置制取B的最高价氧化物
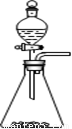
② 用C单质做成的槽车,都可用来运输甲的浓溶液
③ C和铜与稀硫酸组成的原电池,C电极被还原
④ D单质在氧气中燃烧后的产物可用在防毒面具中作供氧剂
⑤ 鼓励乘坐公交车出行,倡导低碳生活,是控制和治理BO2解决“温室效应”的有效途径之一
 ⑥ DF的电子式为H∶Cl∶
⑥ DF的电子式为H∶Cl∶
(3)将E的常见氧化物(该氧化物能使品红溶液褪色)通入由CuSO4和NaCl混合的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀进行元素质量分数分析,可知其中含Cl:35.7%,Cu:64.3%,则该氧化物在上述反应中的作用是 。
A.漂白剂 B.氧化剂 C.还原剂
(4)请用化学方法加以验证(3)中的氧化物,简要写出实验方法、试剂及预期可观察到的现象 。
有关短周期元素A、B、C、D、E、F的信息如下:
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | M层上有3个电子 |
| D | 短周期原子半径最大的主族元素 |
| E | 其单质是淡黄色固体 |
| F | 最高正价与最低负价代数和为6 |

 ⑥ DF的电子式为H∶Cl∶
⑥ DF的电子式为H∶Cl∶| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | M层上有3个电子 |
| D | 短周期原子半径最大的主族元素 |
| E | 其单质是淡黄色固体 |
| F | 最高正价与最低负价代数和为6 |
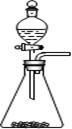
 ⑥ DF的电子式为H∶Cl∶
⑥ DF的电子式为H∶Cl∶《化学与生活》
(1)随着生活水平的提高,人们越来越关注营养平衡和自身的健康.
①粮食中的淀粉在人体中水解最终转化成________,该物质在人体内被氧化,最终生成CO2和H2O,该过程对人体健康的意义是________.
②食品添加剂亚硝酸钠的外观像食盐,并有咸味,但亚硝酸钠有很强的毒性.亚硝酸钠属于________(选填“调味剂”、“防腐剂”或“着色剂”).
③维生素C也称抗坏血酸.血液中运载氧的血红蛋白中含有Fe2+,人之所以患坏血病,是因为人体从摄取的食物中吸收的铁主要是Fe3+,Fe3+不能被人体吸收.维生素C的主要摄入途径是________,维生素C在抗坏血病方面的作用原理是________.
(2)中国是世界上最早研究和生产合金的国家之一.
①在原子反应堆中得以广泛应用的钠钾合金在常温下呈液态,说明合金的熔点比其成分金属的熔点________.
②铜锌合金外观和金(Au)相似,常被误认为黄金.试写出一种鉴别黄铜与黄金的化学方法________.铜器表面容易生成一层薄薄的铜绿[主要成份是Cu2(OH)2CO3],请写出铜在潮湿的空气发生电化学腐蚀时的负极反应式________;用盐酸可以除去铜器表面的铜绿,该反应的化学方程式为________.
③下列对金属制品采取的防护方法不正确的是________(填序号).
A.在电线的外面包上一层塑料层
B.在自行车钢圈上镀上一层金属铬
C.在海轮的铁制外壳上焊上铜块
(3)①CO2是目前大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.请你写出有利于降低大气中CO2浓度的一项措施________.
②水中含有的悬浮颗粒物等杂质,可以加入________等混凝剂进行净化处理,利用其溶解后形成的________具有吸附作用使水中的悬浮颗粒物沉降.
③最近,国内第一个跨区域日处理垃圾1000吨以上的垃圾焚烧发电厂在江苏如皋投入使用.下面列出了现代生活中的常见垃圾:
A.废纸
B.废电池
C.易拉罐
D.玻璃瓶
E.塑料制品
在焚烧处理前,除废电池外,还有________(填序号)应剔除并回收,
随意丢弃电池造成的主要危害是________.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com