
题目列表(包括答案和解析)
 硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2(约45%)、Fe2O3(约40%)、Al2O3(约10%)和MgO(约5%).某同学设计了如下方案,分离样品中各种金属元素.请回答下列问题.
硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2(约45%)、Fe2O3(约40%)、Al2O3(约10%)和MgO(约5%).某同学设计了如下方案,分离样品中各种金属元素.请回答下列问题.
硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。目前我国已经在技术上取得突破——从硫酸渣中分离出各种成分并加以利用。其流程和相关数据如下:

查资料得知:
|
物质名称 |
溶度积(Ksp) |
pH值 |
|
|
开始沉淀 |
完全沉淀 |
||
|
Mg(OH)2 |
5.6×10-12 |
9.3 |
10.8 |
|
Fe(OH)3 |
2.8×10-16 |
2.7 |
3.7 |
|
Al(OH)3 |
1.3×10-33 |
3.7 |
4.7 |
请回答下列问题:
(1)写出固体A的化学式为 。
(2)若要测定溶液的pH是否达到3.7,下列实验用品中可选用的是 。
A.石蕊试液 B.广泛pH试纸 C.精密pH试纸 D.pH计
(3)完成下列离子反应方程式
①溶液D生成固体E ; ②溶液F生成固体G 。
(4)要将固体C、固体E和固体G都转化为相应的稳定氧化物,需进行的实验操作为 。
(5)若不考虑溶液体积的变化,请计算溶液H中c(Mg2+)= 。
硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。目前我国已经在技术上取得突破——从硫酸渣中分离出各种成分并加以利用。其流程和相关数据如下: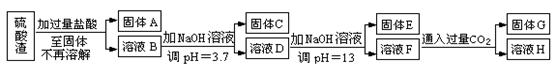
查资料得知:
| 物质名称 | 溶度积(Ksp) | pH值 | |
| 开始沉淀 | 完全沉淀 | ||
| Mg(OH)2 | 5.6×10-12 | 9.3 | 10.8 |
| Fe(OH)3 | 2.8×10-16 | 2.7 | 3.7 |
| Al(OH)3 | 1.3×10-33 | 3.7 | 4.7 |
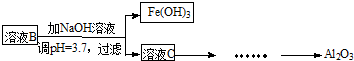 硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2(约45%)、Fe2O3(约40%)、Al2O3(约10%)和MgO(约5%).某同学设计了如下方案,分离样品中各种金属元素.请回答下列问题.
硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2(约45%)、Fe2O3(约40%)、Al2O3(约10%)和MgO(约5%).某同学设计了如下方案,分离样品中各种金属元素.请回答下列问题.
(10分)硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2(约45%)、Fe2O3(约40%)、Al2O3(约10%)和MgO(约5%)。某同学设计了如下方案,分离样品中各种金属元素。请回答下列问题。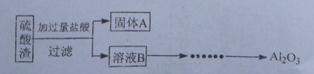
(1)写出溶液B的溶质是 。
(2)参照以下框的形式进一步完成“溶液C”到“Al2O3”的流程(注明试剂、条件和操作)。
(3)为了分析某硫酸渣中铁元素的含量,先将硫酸渣预处理,把铁元素还原成 Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。
①判断到达滴定终点的现象是 。
②某同学称取2.000g硫酸渣,预处理后在容量瓶中配制成100mL溶液,移到25.00mL试样溶液,用0.0050mol·L-1KMnO4标准溶液滴定,达到滴定终点时,消耗标准溶液20.00mL,则残留物中铁元素的质量分数是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com