CO
2、SO
2、NOx是重要的非金属氧化物,与我们的生存环境息息相关.
(1)SO
2、NOx是形成酸雨和光化学烟雾的环境污染性气体,研究发现,空气中少量的 NO
2能参与硫酸型酸雨的形成,反应过程如下:
①SO
2+NO
2=SO
3+NO ②SO
3+H
2O=H
2SO
4 ③2NO+O
2=2NO
2.
则NO
2在上述过程中的作用与H
2SO
4在下述变化中的作用相似的是______.
?A.潮湿的氯气通过盛有浓H
2SO
4的洗气瓶 B.硫化氢通入浓H
2SO
4中
?C.亚硫酸钠固体中加入H
2SO
4 D.制备乙酸乙酯时加入浓H
2SO
4(2)CO
2可用NaOH溶液吸收得到Na
2CO
3或NaHCO
3.
?①Na
2CO
3俗称纯碱,因CO
32-水解而使其水溶液呈碱性,试写出CO
32-水解的离子方程式(忽略第二步水解)______,其水解反应的平衡常数(即水解常数)的表达式为K
h=______.
?②已知25℃时,K
h=2×10
-4mol/L,则当溶液中c(HCO
3-):c(CO
32-)=2:1时,试求溶液的pH=______.
?③0.1mol/L Na
2CO
3溶液中c(OH
-)-c(H
+)=______[用含c(HCO
-3)、c(H
2CO
3)的关系式表示].
(3)汽车尾气的主要成分是一氧化碳和氮氧化物,治理尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g)?N
2(g)+2CO
2(g);△H<0.
若在一定温度下,将2molNO、lmolCO充入固定容积的容器中,反应过程中各物质的浓度变化如图所示.则从开始到达到平衡状态的过程中,平均反应速率v(CO
2)=______(结果保留两位有效数字).该温度下,反应的化学平衡常数为:K=______(用分数表示).20min时,若改变反应条件,导致N
2浓度发生如图所示的变化,则改变的条件可能是______(填字母).
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO
2的物质的量
A.只有①B.只有②C.只有③D.只有④

 CO2、SO2、NOx是重要的非金属氧化物,与我们的生存环境息息相关.
CO2、SO2、NOx是重要的非金属氧化物,与我们的生存环境息息相关.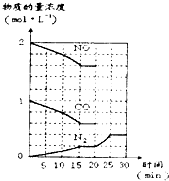

 CO2、SO2、NOx是重要的非金属氧化物,与我们的生存环境息息相关.
CO2、SO2、NOx是重要的非金属氧化物,与我们的生存环境息息相关.