
题目列表(包括答案和解析)
 2SO3(g) 某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示。
2SO3(g) 某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示。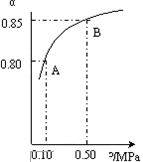
 2SO3(g) 某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示。
2SO3(g) 某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示。

物质A中只含有C、H、O三种元素,能发生银镜反应.物质C的相对分子质量为104.A与其他物质之间的转化关系如下图所示:
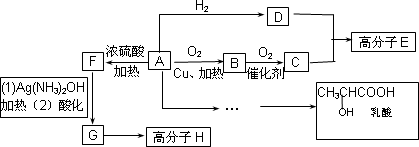
已知:(1)有机物之间的转化关系以及转化过程相对分子质量变化如下:
物质转化关系:RCH2OH RCHO RCOOH
相对分子质量:M M-2 M+14
(2)RCH![]() CH2+HBr
CH2+HBr![]() RCH(Br)CH3
RCH(Br)CH3
回答下列问题:
(1)H结构简式_______________.
(2)一定条件下B发生银镜反应的化学方程式为:_______________.
(3)C、D在一定条件下反应还能生成八元环状物,其化学反应方程式为_______________.
(4)在有机合成中,很多复杂的有机物都是从碳原子数小于或等于4有机物合成的.其中有机物F可以从甲烷合成得到,他的第一步反应是甲烷与氯气的取代反应,若此反应理论上欲获得最多的氯化氢,设V(Cl2)/V(CH4)=x,则x的取值范围是________.
(5)请设计合理方案从A合成乳酸(用反应流程图表示,并注明反应条件).
例:由乙醇合成聚乙烯的反应流程图可表示为:
CH3CH2OH![]() CH2
CH2![]() CH2
CH2![]()
![]()
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com