
题目列表(包括答案和解析)
(1)配制50 g溶质质量分数为5%的氯化钠溶液需氯化钠________g.如图是配制的一些操作:
写出①~⑤仪器的名称:①________②________③________④________⑤________;
用序号A、B、C、D、E表示正确的实验操作顺序为________.
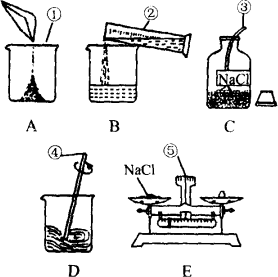
(2)如用5%的氯化钠溶液(密度为1.03 g/cm3)配制50 g 1%的氯化钠溶液,需5%的氯化钠溶液________mL,需水________mL.配制过程不必使用上图①~⑤仪器中的(填名称)________;
(3)如果所配制的溶液中氯化钠的质量分数小于5%,则可能造成误差的原因有(至少举出三点)
①________;
②________;
③________.
实验室用密度为1.84 g/cm3、质量分数为98%的浓硫酸和蒸馏水,配制500 g 质量分数
为20%的稀硫酸。需要用多少mL的量筒量取多少mL的浓硫酸?( )
A.100 mL 54.35 mL B.100 mL 55.5 mL
C.250 mL 54.35 mL D.250 mL 55.5 mL
实验室用密度为1.84 g·cm-3的浓硫酸,配制500 g质量分数为20 %的稀硫酸。欲计算所需浓硫酸的体积,你认为下列说法中正确的是( )
A.还需已知水的密度为1 g·cm-3
B.还需已知20%的稀硫酸的密度为1.14 g·cm-3
C.还需已知密度为1.84 g·cm-3的浓硫酸的溶质质量分数为98%
D.题给条件充分,不需要补充其他数据
实验室用密度为1.84 g/cm3、质量分数为98%的浓硫酸和蒸馏水,配制500 g质量分数为20%的稀硫酸。需要用多少mL的量筒量取多少mL的浓硫酸?( )
A.100 mL 54.35 mL
B.100 mL 55.5 mL
C.250 mL 54.35 mL
D.250 mL 55.5 mL
实验室用密度为1.84 g/cm3、质量分数为98%的浓硫酸和蒸馏水,配制500 g 质量分数
为20%的稀硫酸。需要用多少mL的量筒量取多少mL的浓硫酸?( )
A.100 mL 54.35 mL B.100 mL 55.5 mL
C.250 mL 54.35 mL D.250 mL 55.5 mL
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com