肥田粉的主要成分是硫酸铵.现有一包标有含氮量为20.0%的肥田粉样品,小庆和小鸿为了计算该肥田粉中硫酸铵的质量分数,他们称取7.5g样品,分别采取下列方法:
小庆根据化学式计算:
解:硫酸铵中氮元素的质量分数:
| N的相对原子质量×2 |
| (NH2)2SO4的相对分子质量 |
×%
=
×%
=21.2%
设7.5g样品中含硫酸铵的质量为x.
x×21.2%=7.5g×20%
x=7.08g
样品中含硫酸铵的质量分数为:
×100%=94.4%
答:样品中含硫酸铵的质量分数为94.4%.
小鸿通过实验并根据化学方程式计算:
用称取的7.5g样品与足量的熟石灰混合加热,直到不再产生气体为止,得到纯净、干燥的氨气1.7g.该反应的化学方程式为:
(NH
4)
2SO
4+Ca(0H)
2CaSO
4+2NH↑+2H
2O
(小鸿的计算过程由你来完成)
回答:
(1)请你根据小鸿的实验结果,计算样品中硫酸铵的质量分数.(结果精确到0.1%).
(2)你的计算结果和小庆的计算结果
不同
不同
(填“相同”或“不同”),原因是
小鸿在收集过程中部分氨气逸散
小鸿在收集过程中部分氨气逸散
.
(3)根据小鸿实验的反应原理分析,施用肥田粉时应注意
不能与熟石灰等物质混合使用(合理即可)
不能与熟石灰等物质混合使用(合理即可)
.

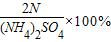
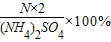
 ×100%
×100% 100%
100%

 ×100%
×100% 100%
100%