
题目列表(包括答案和解析)
 金属镁将成为二十一世纪大有前途的绿色金属材料.
金属镁将成为二十一世纪大有前途的绿色金属材料.| 所加氢氧化钠溶液的次数 | 第一次 | 第二次 | 第三次 |
| 剩余固体的质量/g | 10.6 | 5.2 | 4.0 |
| 猜想与假设 | 实验步骤 | 现象及结论 |
| 此气体可能是氧气 | 收集产生的气体,________ | ________. |

| 相关的质量 | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
| 所加入稀盐酸的质量(g) | 50 | 50 | 50 | 50 | 50 |
| 烧杯中剩余的质量(g) | 72.8 | 120.6 | 168.4 | 216.2 | 266.2 |
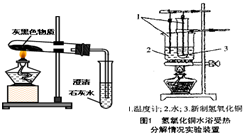
 2CuO+CO2↑+H2O
2CuO+CO2↑+H2O
质 装置 量 时间 | 装置① | 装置③ |
| 实验前 | 220.0克 | 195.0克 |
| 实验后 | 222.1克 | 199.4克 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com