
题目列表(包括答案和解析)
铜单质及其化合物在很多领域有重要的用途,如超细铜粉可应用于导电材料、催化剂等领域中。超细铜粉的某制备方法如下:

(1)[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能从大到小的顺序为: 。
(2) SO42-中硫原子的杂化轨道类型是 :写出一种与SO42-互为等电子体的分子 。
(3)某反应在超细铜粉做催化剂作用下生成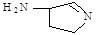 ,则分子中 σ 键与 π 键之比为 。
,则分子中 σ 键与 π 键之比为 。
(4)该化合物[Cu(NH3)4]SO4中存在的化学键类型有 。(填字母)
A.离子键; B.金属键; C.配位键; D.非极性键;E.极性键
(5)NH4CuSO3中的金属阳离子的核外电子排布式为 。
(6)铜的某氯化物的晶胞结构如图所示,该化合物的化学式为 。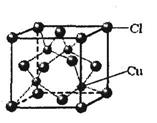
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |


 化合
化合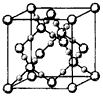
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com