
题目列表(包括答案和解析)
A.同周期元素的原子半径从左到右逐渐增大
B.第三周期金属元素阳离子的氧化性随原子序数增大而增强
C.第三周期非金属元素阴离子的还原性随原子序数增大而增强
D.同主族元素单质的熔点从上到下逐渐升高
有关元素X、Y、Z、D、E的信息如下:
| 元素 | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074nm |
| Y | 所在主族序数与所在周期叙述之差为4 |
| Z | 原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物对应的水化物,能按1:1电力出电子数相等的阴、阳离子 |
| E | 其单质有多中同素异形体,一种为自然界中硬读最大 |
(1)画出Y的离子结构示意图_________________________;
(2)写出D的最高4氧化物的水化物电离出的阴离子的电子式_________;
(3)![]() 的溶液与Y的单质可能发生反应,其反应的离子方程式为__________;
的溶液与Y的单质可能发生反应,其反应的离子方程式为__________;
(4)用化学符号表示,![]() 的水溶液中各离子的浓度关系________(列等式);
的水溶液中各离子的浓度关系________(列等式);
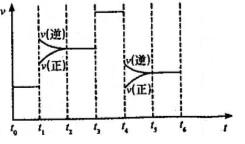 (5)已知
(5)已知![]() 与
与![]() 可发生反应
可发生反应
![]() ;当反应达到
;当反应达到
平衡时不断改变条件(不改变![]() 、
、![]() 、
、![]() 的量)反
的量)反
应速率随时间的变化如右图:其中表示平衡混合物中![]()
含量最高的一段时间是___________;如![]() 平衡常数为
平衡常数为
![]() 平衡常数为
平衡常数为![]() ,则
,则![]() ________
________![]() (填“大于”、
(填“大于”、
“等于”或“小于”)。
| 元素代号 | 相关信息 |
| T | T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X | X的原子最外层电子数是其内层电子数的三倍 |
| Y | 在第三周期金属元素中,Y的简单离子半径最小 |
| Z | T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |


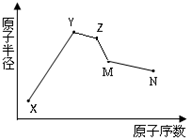 (2012?门头沟区一模)X、Y、Z、M、N五种常见的短周期元素原子半径随原子序数变化如图.已知X的一种原子的质量数为18,中子数为10;Y和Ne原子的核外电子数相差1;M的单质是一种常见的半导体材料;N的原子半径在同周期主族元素中最小;Y、Z、N三种元素的最高氧化物对应的水化物两两之间可以发生反应.下列说法错误的是( )
(2012?门头沟区一模)X、Y、Z、M、N五种常见的短周期元素原子半径随原子序数变化如图.已知X的一种原子的质量数为18,中子数为10;Y和Ne原子的核外电子数相差1;M的单质是一种常见的半导体材料;N的原子半径在同周期主族元素中最小;Y、Z、N三种元素的最高氧化物对应的水化物两两之间可以发生反应.下列说法错误的是( )湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com